
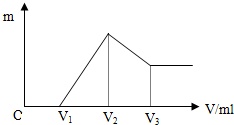
 將0.1mol的鎂、鋁混合物溶于100ml 4mol/L的鹽酸中,然后滴加NaOH溶液,在滴加NaOH溶液過程中,沉淀的質量m隨加入NaOH溶液的體積V變化的關系如圖所示.
將0.1mol的鎂、鋁混合物溶于100ml 4mol/L的鹽酸中,然后滴加NaOH溶液,在滴加NaOH溶液過程中,沉淀的質量m隨加入NaOH溶液的體積V變化的關系如圖所示.分析 (1)由圖可知,從開始至加入NaOH溶液V1mL,沒有沉淀生成,說明原溶液中鹽酸溶解Mg、Al后,鹽酸有剩余,此時發生的反應為:H++OH-=H2O;
繼續滴加NaOH溶液,到氫氧化鈉溶液為V2時,沉淀量最大,此時為Mg(OH)2和Al(OH)3,此時發生的反應為:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液為氯化鈉溶液;
再繼續滴加NaOH溶液,氫氧化鋁與氫氧化鈉反應生成偏鋁酸鈉與水,發生反應Al(OH)3+OH-=AlO2-+2H2O;
(2)V2時沉淀達到最大量,此時溶質為氯化鈉,根據氯原子守恒計算出氫氧化鈉的物質的量,再根據c=$\frac{n}{V}$計算出氫氧化鈉溶液的濃度;
(3)由圖可知,0~V1發生H++OH-=H2O,V1~V2發生Mg2+、Al3+轉化為沉淀的反應,V2~V3段發生Al(OH)3+OH-=AlO2-+2H2O,結合反應及原子守恒計算解答.
解答 解:(1)由圖可知,從開始至加入NaOH溶液V1mL,沒有沉淀生成,說明原溶液中鹽酸溶解Mg、Al后,鹽酸有剩余,此時發生的反應為:H++OH-=H2O;繼續滴加NaOH溶液,到氫氧化鈉溶液為V2時,沉淀量最大,此時為Mg(OH)2和Al(OH)3,此時發生的反應為:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液為氯化鈉溶液;再繼續滴加NaOH溶液,氫氧化鋁與氫氧化鈉反應生成偏鋁酸鈉與水,發生反應為:Al(OH)3+OH-=AlO2-+2H2O,
故答案:H++OH-=H2O;Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(2)V2時沉淀達到最大量,此時溶質為NaCl,根據氯原子守恒可知:n(NaOH)=n(HCl)=4mol/L×0.1L=0.4mol,則該氫氧化鈉溶液濃度為:$\frac{0.4mol}{0.4L}$=1mol/L,
故答案為:1;
(3)若V1=160mL,說明鹽酸有剩余,剩余鹽酸的物質的量為:1mol/L×0.16L=0.16mol,則和金屬反應的鹽酸的物質的量為:4mol/L×0.1L-0.16mol=0.24mol,
設鎂的物質的量是x,鋁的物質的量是y,則:x+y=0.1mol,2x+3y=0.24,解得x=0.06mol,y=0.04mol,
即鎂的物質的量為0.06mol,鋁的物質的量為0.04mol;
V3點時溶液中的溶質是偏鋁酸鈉和氯化鈉,根據原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.04mol+0.4mol=0.44mol,所以氫氧化鈉的體積為:$\frac{0.44mol}{1mol/L}$=0.44L=440mL,
故答案為:0.06; 0.04;440.
點評 本題以圖象形式考查混合物計算,題目難度中等,明確每一段圖象發生的化學反應及拐點代表的含義、溶液中溶質的成分為解答關鍵,然后結合方程式對有關問題進行分析,注意守恒思想的運用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 2H2+O2 $\frac{\underline{\;點燃\;}}{\;}$2H2O | |
| B. | CaO+H2O=Ca(OH)2 | |
| C. | CaCO3 $\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | |
| D. | CH3CH2OH(酒精)+3O2 $\frac{\underline{\;點燃\;}}{\;}$2CO2+3 H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將某無色氣體通入品紅溶液中,品紅溶液褪色,則此氣體一定是SO2 | |
| B. | 取少許某溶液并滴加數滴硫氰化鉀溶液,無明顯現象,再滴加數滴H2O2溶液,溶液變血紅色,則原溶液中一定含Fe2+ | |
| C. | 在硫酸鋇沉淀中加入濃碳酸鈉溶液充分攪拌后,取沉淀(洗凈)放入鹽酸中有氣泡產生,說明Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 在淀粉溶液中加入稀硫酸并加熱片刻再加入適量銀氨溶液,水浴加熱后沒有銀鏡生成,說明淀粉沒有水解 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
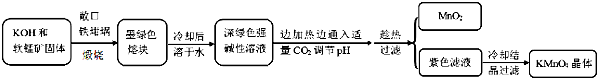
| 物質 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
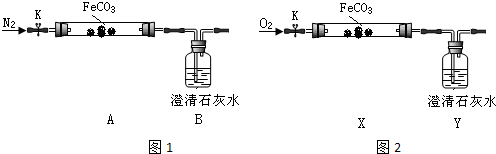
| 實驗編號 | 實驗步驟 | 實驗現象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液變紅色 |
| ii | 向乙溶液滴加酸性高錳酸鉀溶液 | 溶液不褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用帶玻璃塞的玻璃瓶盛放NaOH溶液 | |
| B. | SiO2和CO2都是酸性氧化物,既能與水反應,又能與NaOH溶液反應 | |
| C. | SiO2與純堿在高溫條件下反應生成CO2,說明硅酸的酸性比碳酸強 | |
| D. | 石灰石是工業制備普通玻璃和普通水泥的共同原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 左下方區域的金屬元素 | B. | 金屬和非金屬分界線附近的元素 | ||
| C. | 過渡元素 | D. | 稀有氣體元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
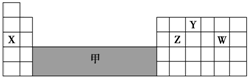
| A. | 可在灰色區域“甲”中尋找半導體材料 | |
| B. | X、Z、W 最高價氧化物對應的水化物之間兩兩能相互反應 | |
| C. | 氣態氫化物的穩定性:Z<W | |
| D. | X只能形成一種氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | V(B2)=0.8mol/(L•s) | B. | V(D)=0.6mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=0.8mol/(L•min) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com