
【題目】已知烴B分子內C、H原子個數比為1:2,相對分子質量為28,核磁共振氫譜顯示分子中只有一種化學環境的氫原子,且有如下的轉化關系:

(1)B的結構簡式是_________________;
(2)A可能屬于下列哪類物質__;
a.醇 b.鹵代烴 c.酚 d.羧酸
(3)反應①是D與HCl按物質的量之比1:1的加成反應,則D的分子式是_____________,反應②可表示為:G+NH3→F+HCl (未配平),該反應配平后的化學方程式是____________(有機化合物均用結構簡式表示);
化合物E(HOCH2CH2Cl)和 F[HN(CH2CH3)2]是藥品普魯卡因合成的重要中間體,普魯卡因的合成路線如下:(已知: )
)
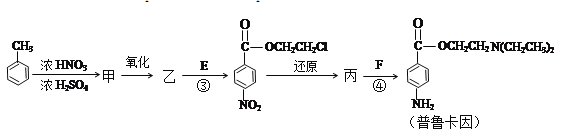
(4)甲的結構簡式是__,由甲苯生成甲的反應類型是__;
(5)乙中有兩種含氧官能團______,反應③的化學方程式是:______;
(6)丙中官能團的名稱是______;
(7)普魯卡因有兩種水解產物丁和戊;
①戊與甲互為同分異構體,戊的結構簡式是__;
②戊經聚合反應制成的高分子纖維廣泛用于通訊、宇航等領域.該聚合反應的化學方程式是__;
③D的紅外光譜表明分子內除C﹣H鍵、C﹣C鍵外還含有兩個C﹣O單鍵.則D與F在一定條件下反應生成丁的化學方程式是______。
【答案】 CH2=CH2 ab C2H4O 2CH3CH2Cl+NH3→NH(CH2CH3)2+2HCl ![]() 取代反應 羧基、硝基
取代反應 羧基、硝基 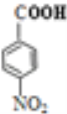 +HOCH2CH2Cl
+HOCH2CH2Cl![]()
 +H2O 酯基、氯原子、氨基
+H2O 酯基、氯原子、氨基 ![]()
![]()
![]()
【解析】烴B分子內C、H原子個數比為1:2,相對分子質量為28,令分子式CnH2n,則14n=28,計算得出n=2,核磁共振氫譜顯示分子中只有一種化學環境的氫原子,則B為CH2=CH2,A可能為鹵代烴或醇,發生消去反應生成乙烯,B→D發生氧化反應,(3)中反應(1)是D與HCl按物質的量之比1:1的加成反應,D可以和銀氨溶液反應,則D為CH3CHO,B與HCl發生加成反應生成G,G為CH3CH2Cl,G與氨氣發生取代反應生成F,據此解答。
由普魯卡因的合成路線可以知道,甲苯發生硝化反應生成甲為![]() ,甲氧化生成乙為
,甲氧化生成乙為![]() ,乙與E發生酯化反應生成
,乙與E發生酯化反應生成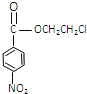 ,
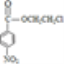
,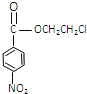 中硝基變還原為氨基生成丙為
中硝基變還原為氨基生成丙為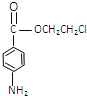 ,丙與F發生取代反應生成普魯卡因,然后結合物質的性質來解答。
,丙與F發生取代反應生成普魯卡因,然后結合物質的性質來解答。
詳解:(1)由上述分析可以知道,B為CH2=CH2 ,因此,本題正確答案是:CH2=CH2 ;
(2)A發生消去反應生成乙烯,則A可能為鹵代烴或醇,故選:ab;
(3)反應(1)是D與HCl按物質的量之比1:1的加成反應,則D的分子式為C2H4O ,反應(2)為2CH3CH2Cl+NH3→NH(CH2CH3)2+2HCl ,
因此,本題正確答案是:C2H4O ;2CH3CH2Cl+NH3→NH(CH2CH3)2+2HCl ;
(4)由上述分析可以知道,甲為對硝基甲苯,結構簡式為![]() ,由甲苯生成甲的反應類型是取代反應,因此,本題正確答案是:
,由甲苯生成甲的反應類型是取代反應,因此,本題正確答案是:![]() ;取代反應;
;取代反應;
(5)乙為![]() ,含有的官能團為羧基、硝基,反應(3)的反應程式為:
,含有的官能團為羧基、硝基,反應(3)的反應程式為: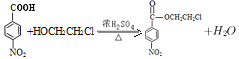 ,
,
因此,本題正確答案是:羧基;羧基; 。
。
(6)丙為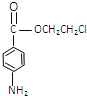 其中含有官能團的名稱是酯基、氯原子、氨基;
其中含有官能團的名稱是酯基、氯原子、氨基;
(7)①普魯卡因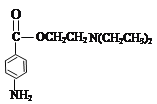 的水解產物有兩種,分別是:
的水解產物有兩種,分別是:![]() 、
、![]() ,其中
,其中![]() 和
和![]() 互為同分異構體;
互為同分異構體;
②![]() 中氨基和羧基發生縮聚反應,生成
中氨基和羧基發生縮聚反應,生成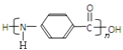 。該聚合反應的化學方程式是
。該聚合反應的化學方程式是 ![]() ;
;
③D與F在一定條件下反應生成丁的化學方程式是![]() 。
。


科目:高中化學 來源: 題型:
【題目】元素周期表是學習化學的重要工具,它隱含許多信息和規律。
He | |||||||||||||||||
d | e | ||||||||||||||||
a | c | ||||||||||||||||
b | |||||||||||||||||
(1)請在圖中用實線補全元素周期表的邊界_________________________
(2)寫出c在周期表中對應的位置________,并畫出其原子結構示意圖___________。
(3)相同大小的a、b兩種元素的單質分別投入水中,反應較劇烈的是_______(用化學式表示, 下同),其與水反應的化學方程式為_________。
(4)比較d元素和e元素原子半徑的大小_________(用“>”連接)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制取肥皂的實驗有以下步驟:
①在一個干燥的蒸發皿中加入植物油8mL、乙醇8mL、NaOH溶液4mL
②在不斷攪拌下,給蒸發皿中液體微微加熱,直到混合物變稠
③繼續加熱,直到皂化反應完成
④把盛混合物的蒸發皿放在冷水浴中冷卻.等待片刻,向混合物中加20mL熱蒸餾水,再放在冷水中冷卻.然后加入25mL NaCl飽和溶液充分攪拌
⑤用紗布濾出固體物質,棄去濾液.把固體物質擠于、壓成條狀、晾干,即得肥皂
根據實驗,填空:
(1)在制肥皂時加入乙醇是利用了乙醇的什么性質?_________;
(2)如何驗證皂化反應已完成?_________;
(3)在操作④中加入飽和NaCl溶液的作用是_________;
(4)寫出硬脂酸甘油酯發生皂化反應的化學方程式_________;
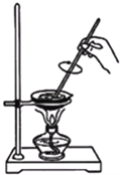
(5)取用蒸發皿用的儀器是_________;
(6)工業上大規模生產用水蒸氣加熱的優點_________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把含硫酸銨和硝酸銨的混合液a L分成兩等份。一份加入含b mol NaOH的溶液并加熱,恰好把NH3全部趕出;另一份需消耗c mol BaCl2才能使SO42-完全沉淀,則原溶液中NO3-的物質的量濃度為(單位均為mol·L-1)
A. (c-2b)/a B. (2b-4c)/a C. (2b-c)/a D. (b-4c)/a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學課外興趣小組學生在實驗室里制取的乙烯中常混有少量的二氧化硫,老師啟發他們并由他們自己設計了下列實驗圖以確認上述混合氣體中有C2H4和SO2,回答下列問題:
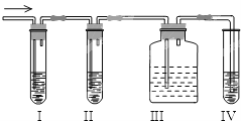
(1)裝置應盛放的試劑是I ____,IV _______(將下列有關試劑的序號填入空格內);
A.品紅溶液 B.NaOH溶液 C.濃硫酸 D.酸性KMnO4溶液
(2)能說明SO2氣體存在的現象是____________________________;
(3)使用裝置II的目的是____________________________________ ;
(4)使用裝置III的目的是 ___________________________________;
(5)確定含有乙烯的現象是___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表與元素周期律在學習、研究和生產實踐中有很重要的作用。下表列出了①~⑩九種元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ⑩ | ||||||
2 | ⑥ | ⑦ | ||||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑤ | ⑨ |
請回答:
(1)在表里所列元素中,最高價氧化物對應的水化物中,酸性最強的是________(填化學式)。
(2)在②③④三種元素的最高價氧化物對應的水化物中,堿性最強的是_______(填化學式)。電子式:________。
(3)⑦⑧⑨形成的氣態氫化物中,最穩定的是________(填化學式)。
(4)元素⑥的氫化物的化學式是________,電子式:________
(5)⑧元素與②元素形成的化合物的電子式:________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的Cl2通入一定濃度的苛性鉀溶液中,兩者恰好完全反應(已知反應過程放熱),生成物中有三種含氯元素的離子,其中ClO-和ClO3-兩種離子的物質的量(n)與反應時間(t)的變化示意圖如右圖所示。下列說法正確的是( )
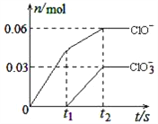
A. 苛性鉀溶液中KOH的物質的量是0.09mol
B. ClO3-的生成是由于氯氣的量的多少引起的
C. 在酸性條件下ClO-和ClO3-可生成Cl2
D. 反應中轉移電子的物質的量是0.21mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鋁質輕且有良好的防腐蝕性,在國防工業中有非常重要的作用。完成下列填空:
(1)鎵(Ga)與鋁同族,寫出鎵的氯化物和氨水反應的化學方程式____________。
(2)硅與鋁同周期,SiO2是硅酸鹽玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可寫成Na2O·CaO·6SiO2。盛放NaOH溶液的試劑瓶若用玻璃瓶塞容易形成粘性的硅酸鹽而無法打開,發生反應的化學方程式____________________________________________。長石是鋁硅酸鹽,不同類長石其氧原子的物質的量分數相同,由鈉長石化學式NaAlSi3O8可推知鈣長石的化學式為_______________________。
(3)用鋁和金屬氧化物反應制備金屬單質是工業上較常用的方法 如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,常溫下Al的金屬性比Ba的金屬性______(選填“強”“弱”)。利用上述方法可制取Ba的主要原因是________。
3Ba↑+BaO·Al2O3,常溫下Al的金屬性比Ba的金屬性______(選填“強”“弱”)。利用上述方法可制取Ba的主要原因是________。
A.高溫時Al的活潑性大于Ba B.高溫有利于BaO分解
C.高溫時BaO·Al2O3比Al2O3穩定 D.Ba的沸點比Al的低
查看答案和解析>>
科目:高中化學 來源: 題型:
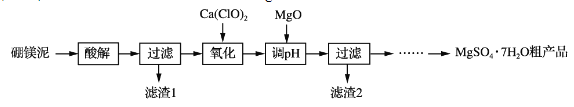
【題目】實驗室用硼鎂泥為原料制取MgSO4·7H2O粗產品的過程如下:
硼鎂泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”時為提高Mg2+的浸出率,可采用的措施是_____(寫一種)。所加酸不宜過量太多的原因是_____。
(2)“氧化”步驟中,若用H2O2代替Ca(ClO)2,則發生反應的離子方程式為______________。實際未使用H2O2,除H2O2成本高外,還可能的原因是______________________________________。
(3)“調pH”時用MgO而不用NaOH溶液的原因是________________________。
(4)結合附表信息,由MgSO4·7H2O粗產品(含少量CaSO4)提純獲取MgSO4·7H2O的實驗方案如下:將粗產品溶于水,_________________________________________________,室溫下自然揮發干燥。(實驗中必須使用的試劑有:飽和MgSO4溶液,乙醇)附:兩種鹽的溶解度(g/100 g水)
溫度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com