
【題目】(1)下列敘述正確的是____________________
A.含有共價鍵的化合物一定是共價化合物
B.現已發現的零族元素的單質在常溫常壓下都是氣體
C.第ⅥA族元素的原子,其半徑越大,越容易得到電子
D.第n主族元素其最高價氧化物分子式為R2On,氫化物分子式為RHn (n≥4)
E.所有主族元素最高正化合價等于最外層電子數
F.稀有氣體原子與同周期I A、ⅡA族元素的簡單陽離子具有相同的核外電子排布
G.共價化合物中不可能含有離子鍵
H.只有非金屬原子間才能形成共價鍵
I.非金屬原子間不可能形成離子化合物
(2)寫出下列物質的電子式
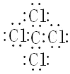
MgBr2 ___________________ CCl4_______________HClO_______________
N2 ___________________ NH4Cl_______________NH3_______________
【答案】BG ![]()
![]()
![]()
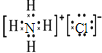
![]()
【解析】
(1)A.含有共價鍵的化合物不一定是共價化合物,也可能是離子化合物,如NaOH,故A錯誤;
B.稀有氣體分子間作用力小,現已發現的零族元素的單質在常溫常壓下都是氣體,故B正確;
C.第ⅥA族元素的原子,其半徑越大,核對電子的引力越小,越難得到電子,故C錯誤;
D.第n主族元素其最高價氧化物對應的化學式為R2On,最高正化合價為+n,所以最低負價為-(8-n),所以氫化物化學式為RH(8-n)(n≥4)或H(8-n)R,故D錯誤;
E.對于主族元素,最高正價=最外層電子數(氧元素、氟元素一般沒有正化合價),故E錯誤;
F.稀有氣體He原子與同周期H簡單陽離子H+的核外電子排布不同,故F錯誤;
G.根據共價化合物的定義,共價化合物中不可能含有離子鍵,故G正確;
H.金屬非金屬原子間也可能形成共價鍵,如AlCl3,故H錯誤;
I.非金屬原子間可能形成離子化合物,如NH4Cl,故I錯誤;
故選BG。
(2)MgBr2為離子化合物,陰離子需要標出最外層電子,![]() ;
;
CCl4 是共價化合物,C在中間,周圍8個電子,Cl原子在四周,每個氯原子周圍也是8個電子,每個Cl原子都和C公用兩個電子,就是四氯化碳的電子式
HClO為共價化合物,分子中存在1個氧氫鍵和1個Cl-O鍵,次氯酸的電子式為:![]() ;
;
N2 中N原子最外層為5個電子,兩個N原子間形成三個共用電子對,氮氣的電子式為:![]() ;
;
NH4Cl氯化銨為離子化合物,電子式中需要標出陰陽離子所帶電荷,氯化銨的電子式為: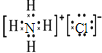 ;
;
NH3氨氣為共價化合物,氨氣中存在3個氮氫鍵,氮原子最外層達到8電子穩定結構,氨氣的電子式為:![]() ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】研究NOx、CO2的吸收利用,對促進低碳社會的構建和環境的保護具有重要意義。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
則C2H4(g)+6NO(g)![]() 3N2(g)+2CO2(g)+2H2O(l)的反應熱△H=______。
3N2(g)+2CO2(g)+2H2O(l)的反應熱△H=______。
(2)用NH3催化還原NOx可以消除氮氧化物的污染。如下圖,采用NH3作還原劑,煙氣以一定的流速通過兩種不同催化劑,測量逸出氣體中氮氧化物含量,從而確定煙氣脫氮率(脫氮率即氮氧化物的轉化率),反應原理為:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。

以下說法正確的是______。
A.催化劑①、②分別適合于250℃和450℃左右脫氮
B.使用第②種催化劑更有利于提高NOx的平衡轉化率
C.相同條件下,改變壓強對脫氮率沒有影響
D.在交叉點A處,不管使用哪種催化劑,上述反應都未達平衡。
(3)工業合成尿素的反應如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0,在恒定溫度下,將NH3和CO2按2:1的物質的量之比充入一體積為10L的密閉容器中(假設容器體積不變,生成物的體積忽略不計),經20min達到平衡,各物質的濃度變化曲線如圖所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定溫度下,將NH3和CO2按2:1的物質的量之比充入一體積為10L的密閉容器中(假設容器體積不變,生成物的體積忽略不計),經20min達到平衡,各物質的濃度變化曲線如圖所示。
①若保持平衡時的溫度和壓強不變,再向容器中充入3mol的CO2,則此時v(正)______v(逆)(填>、<或=)。判斷的理由是______。
②若保持平衡時的溫度和體積不變,25min時再向容器中充入2mol的NH3和1 mol CO2,在40min時重新達到平衡,請在圖中畫出25~50min內NH3的濃度變化曲線。______。

(4)用鋁制作的“快速放電鋁離子二次電池”的原理如右上圖所示(EMI+為有機陽離子、電池工作時離子液體中微粒種類不變)。該電池放電時的負極反應方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在硫酸工業生產中,為了有利于SO2的轉化,且能充分利用熱能,采用了中間有熱交換器的接觸室(見右圖)。下列說法錯誤的是
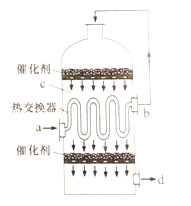
A. a、b兩處的混合氣體成分含量相同,溫度不同
B. c、d兩處的混合氣體成分含量相同,溫度不同
C. 熱交換器的作用是預熱待反應的氣體,冷卻反應后的氣體
D. c處氣體經熱交換后再次催化氧化的目的是提高SO2的轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系。已知在常溫常壓下,A是固體,B、C、D、E是非金屬單質且都是氣體,C呈黃綠色;化合物F是淡黃色固體,化合物G的焰色反應為黃色,化合物Ⅰ和J通常狀況下呈氣態;D和E反應生成一種刺激性氣味的氣體。
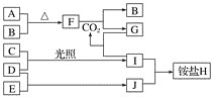
請回答下列問題:
(1)E和J的化學式分別是________和________。
(2)寫出F和CO2反應的化學方程式并用單線橋法表示電子轉移的情況:_________。
(3)將少量單質C通入盛有淀粉碘化鉀溶液的試管中,溶液變藍色,該反應的離子方程式為_________。
(4)標況下3.36 L氣體B與A完全反應,轉移電子的數目為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是主要的溫室氣體,也是一種工業原料。回收利用CO2有利于緩解溫室效應帶來的環境問題。
(1)我國科學家通過采用一種新型復合催化劑,成功實現了CO2直接加氫制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol
25℃、101kPa條件下,CO2與H2反應生成辛烷(以C8H18表示)和液態水的熱化學方程式是_________。
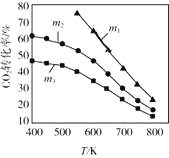
(2)CO2催化加氫合成乙醇的反應原理是:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol圖是起始投料不同時,CO2的平衡轉化率隨溫度的變化關系,m為起始時的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol圖是起始投料不同時,CO2的平衡轉化率隨溫度的變化關系,m為起始時的投料比,即m=![]() 。m1、m2、m3投料比從大到小的順序為_________,理由是_________。
。m1、m2、m3投料比從大到小的順序為_________,理由是_________。
(3)在Cu/ZnO催化劑存在下,將CO2與H2混合可合成甲醇,同時發生以下兩個平行反應:
反應Ⅰ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反應Ⅱ CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同壓強下,經過相同反應時間測得如下實驗數據(其中“甲醇選擇性”是指轉化的CO2中生成甲醇的百分比):
實驗序號 | T/K | 催化劑 | CO2轉化率/% | 甲醇選擇性/% |
實驗1 | 543 | Cu/ZnO納米棒 | 12.3 | 42.3 |
實驗2 | 543 | Cu/ZnO納米片 | 10.9 | 72.7 |
實驗3 | 553 | Cu/ZnO納米棒 | 15.3 | 39.1 |
實驗4 | 553 | Cu/ZnO納米片 | 12.0 | 71.6 |
①對比實驗1和實驗3可發現:同樣催化劑條件下,溫度升高,CO2轉化率升高, 而甲醇的選擇性卻降低,請解釋甲醇選擇性降低的可能原因_______________;
②對比實驗1和實驗 2可發現:在同樣溫度下,采用Cu/ZnO納米片使CO2轉化率降低, 而甲醇的選擇性卻提高,請解釋甲醇的選擇性提高的可能原因____________。
③有利于提高CO2轉化為CH3OH平衡轉化率的措施有_______。
a.使用Cu/ZnO納米棒做催化劑
b.使用Cu/ZnO納米片做催化劑
c.降低反應溫度
d.投料比不變,增加反應物的濃度
e.增大![]() 的初始投料比
的初始投料比
(4)以納米二氧化鈦膜為工作電極,稀硫酸為電解質溶液,在一定條件下通入CO2,電解,在陰極可制得低密度聚乙烯![]() (簡稱LDPE)。
(簡稱LDPE)。
①電解時,陰極的電極反應式是_____________。
②工業上生產1.4×104 kg 的LDPE,理論上需要標準狀況下______L 的CO2。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用價電子對互斥理論(VSEPR)可以預測許多分子或離子的空間構型,也可推測鍵角大小,下列判斷正確的是( )
A.BF3與PCl3為三角錐形B.SO3與CO32-為平面三角形
C.SO2鍵角大于120oD.BF3是三角錐形分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某氣態烴在標準狀況下密度為2.59 g·L-1。
(1)其相對分子質量等于________。
(2)該烴的含碳量為82.8%,則分子中碳、氫原子的個數比是________,分子式是________。
(3)可能的結構簡式及名稱是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二氯丙烷(CH2C1CHClCH3)是一種重要的化工原料,工業上可用丙烯加成法制備,主要副產物為3-氯丙烯(CH2=CHCH2C1),反應原理為:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
請回答下列問題:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)為132kJ·mol-1,則該反應的活化能Ea(逆)為______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)為132kJ·mol-1,則該反應的活化能Ea(逆)為______kJ·mol-1。
(2)一定溫度下,向恒容密閉容器中充入等物質的量的CH2=CHCH3(g)和C12(g)。在催化劑作用下發生反應I、Ⅱ,容器內氣體的壓強隨時間的變化如下表所示。
時間/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
壓強/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用單位時間內氣體分壓的變化來表示反應速率,即![]() ,則前120min內平均反應速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小數點后2位)。
,則前120min內平均反應速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小數點后2位)。
②該溫度下,若平衡時HC1的體積分數為![]() ,則丙烯的平衡總轉化率
,則丙烯的平衡總轉化率![]() _______;反應I的平衡常數Kp=_____kPa-1(Kp為以分壓表示的平衡常數,保留小數點后2位)。
_______;反應I的平衡常數Kp=_____kPa-1(Kp為以分壓表示的平衡常數,保留小數點后2位)。
(3)某研究小組向密閉容器中充入一定量的CH2=CHCH3和C12,分別在A、B兩種不同催化劑作用下發生反應,一段時間后測得CH2C1CHC1CH3的產率與溫度的關系如下圖所示。
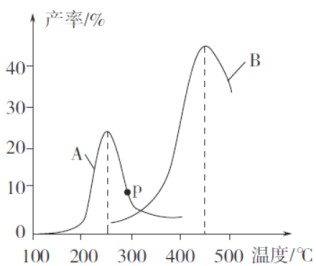
①下列說法錯誤的是___________(填代號)。
a.使用催化劑A的最佳溫度約為250℃
b.相同條件下,改變壓強不影響CH2C1CHC1CH3的產率
c.兩種催化劑均能降低反應的活化能,但△H不變
d.提高CH2C1CHC1CH3反應選擇性的關鍵因素是控制溫度
②在催化劑A作用下,溫度低于200℃時,CH2C1CHC1CH3的產率隨溫度升高變化不大,主要原因是_______________________________________________________________。
③p點是否為對應溫度下CH2C1CHC1CH3的平衡產率,判斷理由是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖是某條件下N2與H2反應過程中能量變化的曲線圖。下列敘述正確的是( )
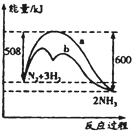
A. 該反應的熱化學方程式為:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 正反應的活化能大于逆反應的活化能
C. b曲線是加入催化劑時的能量變化曲線
D. 使用催化劑后反應的焓變減小,N2轉化率增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com