
【題目】圖中,A為一種中學化學中常見的單質,B、C、D、E是含有A元素的常見化合物。它們的焰色實驗均為黃色。

(1)寫出下列物質的化學式:B___。
(2)以上6個反應中屬于氧化還原反應的有___(填寫編號)。
(3)寫出A →C反應的離子方程式___。
(4)寫出B→C反應的離子方程式:___;E→D的化學方程式:___。
(5)加熱5.00gD和E的固體混合物,使E完全分解,固體混合物的質量減少了0.31g,則原混合物中D的質量分數為___。
【答案】Na2O2 ①②③④ 2Na+2H2O=2Na++2OH-+H2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑ 2NaHCO3![]() Na2CO3+CO2↑+H2O 83.2%
Na2CO3+CO2↑+H2O 83.2%
【解析】
A為一種中學化學中常見的單質,焰色實驗為黃色,則A為Na;Na與氧氣點燃時生成過氧化鈉,則B為Na2O2;過氧化鈉與二氧化碳反應生成碳酸鈉,則D為碳酸鈉;Na與水反應生成C,則C為NaOH;NaOH與過量的二氧化碳反應生成碳酸氫鈉。
(1)分析可知,B為過氧化鈉,化學式為Na2O2;
(2)Na與水、氧氣反應時,化合價發生改變,為氧化還原反應;過氧化鈉與二氧化碳、水反應生成單質氧氣,化合價改變,為氧化還原反應;NaOH與二氧化碳及碳酸氫鈉生成碳酸鈉化合價未變,為非氧化還原反應;
(3)A 、C分別為Na、NaOH,Na與水反應生成氫氧化鈉和氫氣,離子方程式為2Na+2H2O=2Na++2OH-+H2↑;
(4)過氧化鈉與水反應生成氫氧化鈉和氧氣,離子方程式為2Na2O2+2H2O=4Na++4OH-+O2↑;碳酸氫鈉受熱分解生成碳酸鈉、二氧化碳和水,方程式為2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(5)根據方程式減少的質量為1:1的CO2和H2O,則n(NaHCO3)=2n(CO2)=![]() =0.005mol×2,m(NaHCO3)=0.010mol×84g/mol=0.84g,m(Na2CO3)=5.00g-0.84g=4.16g,Na2CO3質量分數為
=0.005mol×2,m(NaHCO3)=0.010mol×84g/mol=0.84g,m(Na2CO3)=5.00g-0.84g=4.16g,Na2CO3質量分數為![]() ×100%=83.2%。
×100%=83.2%。


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】綜合如圖判斷,下列說法正確的是()

A.裝置Ⅰ和裝置Ⅱ中負極反應均是Fe-2e-=Fe2+
B.裝置Ⅰ中正極反應是O2+2H2O+4e-=4OH-
C.裝置Ⅰ和裝置Ⅱ中鹽橋中的陽離子均向右側燒杯移動
D.放電過程中,裝置Ⅰ左側燒杯和裝置Ⅱ右側燒杯中溶液的pH分別增大和減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有0.5L某泉水樣品,其中含有Ca2+0.02g,請計算:
(1)該泉水樣品中Ca2+的物質的量濃度是多少___?
(2)為使該泉水樣品中所含的Ca2+全部沉淀,至少應加入Na2CO3的物質的量是多少___?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將含amol金屬鈉和bmol金屬鋁的合金投入mg足量水中,完全溶解,無金屬剩余,所得溶液密度為dgcm﹣3,下列相關計算式子中錯誤的是( )
A.NaOH的物質的量:(a﹣b)mol
B.NaAlO2的物質的量濃度:![]() mol/L
mol/L
C.標況下生成H2的體積:![]() L
L
D.參加反應的水的質量:18(a+1.5b)g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將1mol CH4和適量的氧氣在密閉容器中點燃,充分反應后,甲烷和氧氣均無剩余,且產物均為氣體 (101 kPa,120℃),其總質量為72g,下列有關敘述不正確的是
A. 若將產物通過堿石灰,則不能全部被吸收,若通過濃琉酸,則不能全部被吸收
B. 產物的平均摩爾質量為42g/mol
C. 若將產物通過濃硫酸充分吸收后恢復至101kPa,120℃,則壓強變為原來的1/3
D. 反應中消耗氧氣為56g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等離子的鹵水為主要原料制備無水CaCl2和Br2,流程如下:
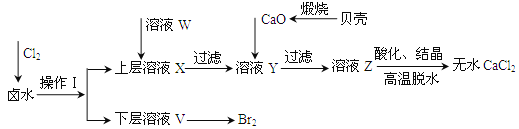
(1)操作Ⅰ使用的試劑是______,所用的主要儀器名稱是_____。
(2)加入溶液W的目的是______,用CaO調節溶液Y的pH,可以除去Mg2+,由表中數據可知,理論上可選擇的pH最大范圍是______,酸化溶液Z時,使用的試劑為______。
開始沉淀時的pH | 沉淀完全時的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8molL-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 將溶液稀釋到原體積的2倍B. 加入適量的醋酸鈉固體
C. 加入等體積0.2 molL﹣1鹽酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應 2KMnO4 + 16HCl =2KCl + 2MnCl2 + 5Cl2↑ + 8H2O 可用于實驗室制取氯氣,
(1)該反應中______是氧化劑,_____是氧化產物,_____元素被還原,
(2)濃鹽酸在反應中顯示出來的性質是________(填序號)。
①只有還原性 ②還原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)①用雙線橋或單線橋標出下列反應的電子轉移方向和數目2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O_____________________
②在標準狀況下,該反應產生2.24 L Cl2時,消耗氧化劑_____mol,被氧化的物質的質量為_____g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.鉛蓄電池在放電過程中,正極得到電子,電極質量增加
B.0.1mol/L CH3COOH溶液加水稀釋后,溶液中![]() 減小
減小
C.SiO2(s)+2C(s)=Si(s)+2CO(g)必須在高溫下反應才能發生,則ΔH>0
D.合成氨生產中將NH3液化分離,可加快正反應速率,提高H2的轉化率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com