
【題目】電化學法還原二氧化碳,不僅能緩解溫室效應還能得到乙烯。回答下列問題:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
則2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____。
(2)電化學法還原二氧化碳為乙烯原理如圖所示。
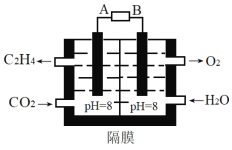
A為電源的___極(填“正”或“負”),陰極電極反應式為___。電路中轉移0.2mol電子,理論上產生氧氣___L(標準狀況)。
(3)銅作陰極能提高還原產物乙烯的選擇性,水溶液中二氧化碳在銅表面還原為乙烯的機理如圖所示(參與反應的水分子及其它生成微粒未畫出)。下列有關說法不正確的是___(填標號)。
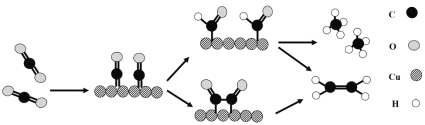
A.銅是二氧化碳轉化為乙烯的催化劑
B.二氧化碳還原產物有甲烷和乙烯
C.兩個反應歷程都是先加氫再除氧
D.兩個反應歷程都出現碳氧鍵的斷裂與碳碳鍵的形成
【答案】+1322.8kJ·mol-1 負 2CO2+8H2O+12e-=C2H4+12OH- 1.12 C
【解析】
(1)結合已知信息,根據蓋斯定律解答;
(2)根據圖知,加入水的電極上失電子生成氧氣,則該電極為陽極,則通入二氧化碳的電極為陰極,連接陰極的電極為原電池負極,陰極上二氧化碳得電子和水生成乙烯和氫氧根離子;每生成1mol氧氣轉移4mol電子,據此計算轉移0.2mol電子生成的氧氣體積;
(3)A.根據圖知,二氧化碳先和Cu反應,最后又生成Cu;
B.二氧化碳在反應中得電子發生還原反應,根據圖知,二氧化碳還原產物還有甲烷;
C.生成乙烯是先除去氧后加氫;
D.兩個反應歷程中都有碳氧鍵的斷裂和碳氫鍵的形成。
(1)①C2H4(g)+H2O(g)═C2H5OH(g)△H1=-45.8 kJ/mol
②C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H2=-1277.0 kJ/mol
根據蓋斯定律,-(①+②)得方程式:2CO2(g)+2H2O(g)═C2H4(g)+3O2(g)△H3=(45.81277.0)kJ/mol=+1322.8 kJ/mol;
(2)根據圖知,加入水的電極上失電子生成氧氣,則該電極為陽極,則通入二氧化碳的電極為陰極,連接陰極的電極為原電池負極,則A為負極,陰極上二氧化碳得電子和水生成乙烯和氫氧根離子,電極反應式為2CO2+8H2O+12e=C2H4+12OH;每生成1mol氧氣轉移4mol電子,據此計算轉移0.2mol電子生成的氧氣體積=![]() ×1mol×22.4L/mol=1.12L;
×1mol×22.4L/mol=1.12L;
(3)A.根據圖知,二氧化碳先和Cu反應,最后又生成Cu,則Cu作催化劑,故A正確;
B.二氧化碳在反應中得電子發生還原反應,根據圖知,二氧化碳還原產物還有甲烷,所以二氧化碳反應還原產物有乙烯和甲烷,故B正確;
C.生成乙烯是先除去氧后加氫,而不是先除氫后除氧,故C錯誤;
D.兩個反應歷程中都有碳氧鍵的斷裂和碳氫鍵的形成,形成碳氫鍵導致生成甲烷和乙烯,故D正確;
答案選C。


 全程金卷系列答案
全程金卷系列答案 快樂5加2金卷系列答案
快樂5加2金卷系列答案科目:高中化學 來源: 題型:
【題目】H2是一種重要的清潔能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2還原 CO反應合成甲醇的熱化學方程式為:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,則ΔH1=___kJmol-1,該反應自發進行的條件為___
CH3OH(g) ΔH1,則ΔH1=___kJmol-1,該反應自發進行的條件為___
A.高溫 B.低溫 C.任何溫度條件下
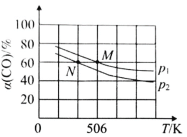
(2)恒溫恒壓下,在容積可變的密閉容器中加入 1molCO和2.2mol H2,發生反應CO(g)+2H2(g)![]() CH3OH(g),實驗測得平衡時CO的轉化率隨溫度、壓強的變化如圖所示。則P1__P2,判斷的理由是_____。
CH3OH(g),實驗測得平衡時CO的轉化率隨溫度、壓強的變化如圖所示。則P1__P2,判斷的理由是_____。
(3)若反應 CO(g)+2H2(g)![]() CH3OH(g)在溫度不變且體積恒定為1的密閉容器中發生,反應過程中各物質的物質的量隨時間變化如表所示:
CH3OH(g)在溫度不變且體積恒定為1的密閉容器中發生,反應過程中各物質的物質的量隨時間變化如表所示:
時間/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各項能作為判斷該反應達到平衡標志的是____(填字母);
C.混合氣體的相對分子質量保持不變 D.混合氣體的密度保持不變
②若起始壓強為P0 kPa,則在該溫度下反應的平衡常數Kp=___(kPa)-2(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
③反應速率若用單位時間內分壓的變化表示,則10min內H2的反應速率v(H2)=___kPamin-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:①101kPa時,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol。下列結論中正確的是
A.若碳的燃燒熱用△H3來表示,則△H3<△H1
B.若碳的燃燒熱用△H3來表示,則△H3>△H1
C.稀硫酸與稀Ba(OH)2溶液反應生成2mol水,放出2×57.3kJ的熱量
D.稀醋酸與稀NaOH溶液反應生成1mol水,放出57.3kJ的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前碘酸鉀被廣泛應用于食鹽加碘。一種由含碘廢水制取碘酸鉀的工藝如下:
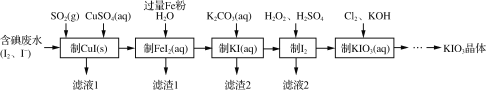
(1)檢驗“含碘廢水”中是否含有單質I2,常用的試劑是______。
(2)通入SO2的目的是將I2還原為I-,該反應的離子方程式為________。
(3)濾渣1的成分為______。(寫化學式)
(4)“制KIO3溶液”時,發生反應的離子方程式為___________。
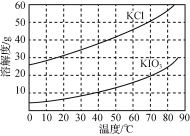
(5)KCl、KIO3的溶解度曲線如圖所示。由上述流程中制得的KIO3溶液得到KIO3晶體的方法為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關反應限度的敘述正確的是
A. 使用催化劑,可降低反應的活化能,加快反應速率,改變反應限度
B. 依據焓判據:NH4HCO3受熱分解可自發進行
C. 大多數化學反應在一定條件下都有一定的限度
D. FeCl3與KSCN反應達到平衡時,向其中滴加少量KCl溶液,則溶液顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnO2和Zn是制造普通干電池的重要原料,現用軟錳礦(主要成分為MnO2)和閃鋅礦(主要成分為ZnS)制備MnO2和Zn的工藝流程如圖:
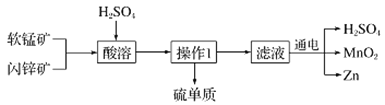
下列說法不正確的是( )
A.干電池是一種將化學能轉變為電能的裝置
B.酸溶時,ZnS作還原劑,每析出12.8gS沉淀,共轉移0.8mol電子
C.通電電解時MnO2在陽極處生成,電極反應為:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循環使用,且可用鹽酸代替硫酸進行酸溶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解質在水溶液中存在各種行為,如電離、水解等,依據所學知識回答下列問題:
(1)t℃時,純水中c(H+)=1×10-6mol·L-1,該溫度下,pH=10的NaOH溶液的物質的量濃度為___。
(2)25℃時,相同物質的量濃度的下列溶液中:①NaCl②NH3·H2O③H2SO4④(NH4)2SO4,其中水的電離程度由大到小順序為___(填標號)。
(3)25℃時,將amol·L-1的醋酸和bmol·L-1的氫氧化鈉溶液等體積混合后,溶液的pH=7,則a___b(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩同學為探究![]() 與可溶性鋇的強酸鹽能否反應生成白色BaSO3沉淀,用下圖所示裝置進行實驗(夾持裝置和A中加熱裝置已略,氣密性已檢驗)。
與可溶性鋇的強酸鹽能否反應生成白色BaSO3沉淀,用下圖所示裝置進行實驗(夾持裝置和A中加熱裝置已略,氣密性已檢驗)。
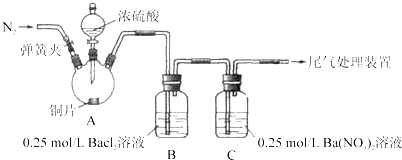
實驗操作和現象:
操作 | 現象 |
關閉彈簧夾,滴加一定量濃硫酸,加熱 | A中有白霧生成,銅片表面產生氣泡,B中有氣泡冒出,產生大量白色沉淀,C中產生白色沉淀,液面上放略顯淺棕色并逐漸消失 |
打開彈簧夾,通入N2,停止加熱,一段時間后關閉 | |
從B、C中分別取少量白色沉淀,加稀鹽酸 | 尚未發現白色沉淀溶解 |
(1)A中反應的化學方程式是_________________。
(2)C中白色沉淀是_______,該沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成淺棕色氣體的化學方程式是______。
(4)分析B中不溶于稀鹽酸的沉淀產生的原因,甲認為是空氣參與反應,乙認為是白霧參與反應。
①未證實各自的觀點,在原實驗基礎上:甲在原有操作之前增加一步操作,該操作是____;乙在A、B間增加洗氣瓶D,D中盛放的試劑是______。
②進行實驗,B中現象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
檢驗白色沉淀,發現均不溶于稀鹽酸。結合離子方程式解釋實驗現象異同的原因:___。
(5)合并(4)中兩同學的方案進行試驗。B中無沉淀生成,而C中產生白色沉淀,由此得出的結論是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的數值,下列說法正確的是
A. 在標準狀況下,11.2L HF含有的分子數目為0.5NA
B. 高溫下,16.8 g Fe與足量水蒸氣完全反應失去0.8NA個電子
C. 常溫下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子數小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羥基數目為0.6NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com