
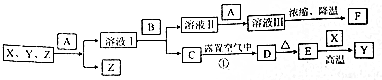
分析 X、Y、Z是三種常見金屬單質,Z為紫紅色,則Z為Cu;B的焰色反應呈紫色(透過藍色鈷玻璃),B中含有K元素,C在空氣中放置生成D為紅褐色固體,則C為Fe(OH)2、D為Fe(OH)3,D加熱生成E為Fe2O3,金屬X與氧化鐵反應得到Fe,為鋁熱反應,則X為Al,Y為Fe,溶液1中含有鋁鹽、亞鐵鹽,與B反應生成氫氧化鐵與溶液Ⅱ,則B為KOH,溶液Ⅱ中含有KAlO2,溶液Ⅱ中加入常見的酸A得到溶液Ⅲ,再經過濃縮、降溫得到F,F可用作凈水劑,可知A為硫酸、F為KAl(SO4)2.12H2O.
解答 解:X、Y、Z是三種常見金屬單質,Z為紫紅色,則Z為Cu;B的焰色反應呈紫色(透過藍色鈷玻璃),B中含有K元素,C在空氣中放置生成D為紅褐色固體,則C為Fe(OH)2、D為Fe(OH)3,D加熱生成E為Fe2O3,金屬X與氧化鐵反應得到Fe,為鋁熱反應,則X為Al,Y為Fe,溶液1中含有鋁鹽、亞鐵鹽,與B反應生成氫氧化鐵與溶液Ⅱ,則B為KOH,溶液Ⅱ中含有KAlO2,溶液Ⅱ中加入常見的酸A得到溶液Ⅲ,再經過濃縮、降溫得到F,F可用作凈水劑,可知A為硫酸、F為KAl(SO4)2.12H2O.
(1)F、Z的化學式分別為KAl(SO4)2.12H2O、Cu,故答案為:KAl(SO4)2.12H2O;Cu;
(2)F中陰離子為硫酸根離子,檢驗硫酸根離子方法是:取少量F于試管中配成溶液,再向其中加入鹽酸酸化的氯化鋇溶液,產生白色沉淀,則證明含有SO42-,
故答案為:取少量F于試管中配成溶液,再向其中加入鹽酸酸化的氯化鋇溶液,產生白色沉淀,則證明含有SO42-;
(3)溶液Ⅰ轉化為溶液Ⅱ的離子方程式:Al3++4OH-=AlO2-+2H2O,
故答案為:Al3++4OH-=AlO2-+2H2O;
(4)反應①的化學方程式:4Fe(OH)2+2H2O+O2=4Fe(OH)3,該反應中每消耗2.24L(標準狀況)O2,其物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,轉移的電子的物質的量為0.1mol×4=0.4mol,
故答案為:4Fe(OH)2+2H2O+O2=4Fe(OH)3;0.4.
點評 本題考查無機物推斷,涉及Al、Fe等元素單質化合物性質,物質的顏色、反應現象及轉化中特殊反應等是推斷突破口,需要學生熟練掌握元素化合物性質,涉及電子式,是對學生綜合能力的考查,難度中等.


科目:高中化學 來源: 題型:解答題
 .
.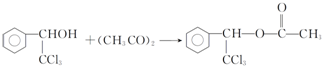 .
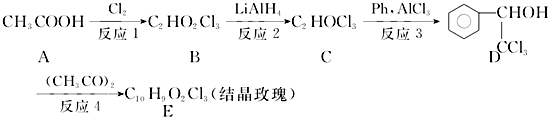
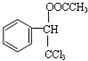
.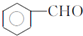 ,F與氯仿合成D的反應方程式為
,F與氯仿合成D的反應方程式為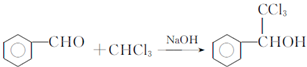 .已知2分子F在KCN存在下可通過授受H反應生成安息香
.已知2分子F在KCN存在下可通過授受H反應生成安息香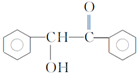 ,請寫出上述反應方程式
,請寫出上述反應方程式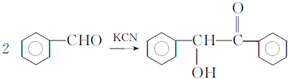 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
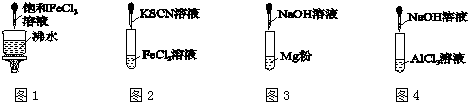
| A. | 圖1產生紅褐色沉淀 | |
| B. | 圖2溶液顏色變紅 | |
| C. | 圖3放出大量氣體 | |
| D. | 圖4先出現白色膠狀沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 鐵螺絲連接鋅板時,鐵不容易生銹 | |
| B. | 反應CaC03(s)=Ca0(s)+C02(g)在常溫下不能發生,則該反應的△H<0 | |
| C. | pH=11的NaOH溶液與pH=3的CH3COOH溶液混合后所得溶液pH小于7 | |
| D. | 電解精煉銅時,每轉移1mol電子陽極上溶解的銅原子數小于0.5×6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com