
【題目】t℃時,將0.5mol/L的氨水逐滴加入10.00mL0.5mol/L鹽酸中,溶液中溫度變化曲線Ⅰ、pH變化曲線Ⅱ與加入氨水的體積的關系如圖所示(忽略混合時溶液體積的變化)。下列說法正確的是( )

A.Kw的比較:a點比b點大
B.b點氨水與鹽酸恰好完全反應,且溶液中c(NH4+)=c(Cl-)
C.c點時溶液中c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D.d點時溶液中c(NH3H2O)+2c(OH-)=c(NH4+)+2c(H+)
【答案】D
【解析】
A.在溶液中存在水的電離平衡,水的電離過程吸收熱量,升高溫度,水的電離程度增大,Kw增大,根據圖示可知,溶液溫度b>a,所以Kw:b>a,A錯誤;
B.HCl與氨水混合,當氨水的體積為10mL時,二者恰好反應產生NH4Cl,該鹽是強酸弱堿鹽,在溶液中NH4+發生水解反應而消耗,所以溶液中c(NH4+)<c(Cl-),B錯誤;
C.在c點溶液中存在NH4Cl、H2O,存在電荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于鹽電離產生的離子濃度遠大于水電離產生的離子濃度,所以溶液中四種離子的濃度不可能相等,C錯誤;
D.d點時溶液為NH4Cl與氨水等物質的量濃度混合溶液,存在電荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),同時存在物料守恒:c(NH4+)+c(NH3H2O)=2c(Cl-),將第一個式子擴大2倍,與第二個式子相減,整理可得:c(NH3H2O)+2c(OH-)=c(NH4+)+2c(H+),D正確;
故合理選項是D。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
【題目】某實驗小組為確定過氧化氫分解的最佳催化條件,用如圖實驗裝置進行實驗,反應物用量和反應停止的時間數據如下:
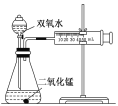
分析表中數據回答下列問題:
MnO2 時間 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 56s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
(1)相同濃度的過氧化氫的分解速率隨著二氧化錳用量的增加而________。
(2)從實驗效果和“綠色化學”的角度考慮,雙氧水的濃度相同時,加入________g的二氧化錳為較佳選擇。
(3)該小組的某同學分析上述數據后認為:“當用相同質量的二氧化錳時,雙氧水的濃度越小,所需要的時間就越少,亦即其反應速率越快”的結論,你認為是否正確________,理由是__________________________________。
(4)為加快過氧化氫的分解速率,除了使用MnO2作催化劑和改變過氧化氫的質量分數之外,還可以采取的加快反應速率的措施有_____。(回答任意兩個合理的措施)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,將3molA氣體和1molB氣體通入一密閉容器中,發生如下反應:3A(g)+B(g)![]() xC(g)請填寫下列空白:
xC(g)請填寫下列空白:
(1)若容器體積固定為2L,反應2min時測得剩余0.6molB,C的濃度為0.4mol/L。
①2min內,A的平均反應速率為________;x=_______;
②若反應經4min達到平衡,平衡時C的濃度__________0.8mol/L填“大于”、“等于”或“小于”![]() ;
;
(2)若維持容器壓強不變:達到平衡時C的體積分數________22%填“大于”、“等于”或“小于”![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列物質中是同系物的有_______;互為同分異構體的有_______________;互為同素異形體的有________________;互為同位素的有_______________;
互為同一物質的有______________;
(1)液氯 (2)氯氣 (3)白磷 (4)紅磷 (5)D (6)T (7) ![]() (8)
(8)![]() (9)CH2 = CH-CH3 (10)
(9)CH2 = CH-CH3 (10) ![]() (11)2,2—二甲基丁烷
(11)2,2—二甲基丁烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于在一定條件下進行的化學反應:2SO2+O2![]() 2SO3,改變下列條件,可以提高反應物中活化分子百分數的是 ( )
2SO3,改變下列條件,可以提高反應物中活化分子百分數的是 ( )
A.增大壓強B.升高溫度C.加入SO2D.減小反應物濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉、鋁、鐵是三種重要的金屬。請回答:
(1)鈉元素的金屬性比鋁的________(填“強”或“弱”)。
(2)將一小塊金屬鈉投入水中,發生反應的離子方程式為______________________;
(3)填寫a、b、c化學式并書寫①的離子方程式(a、b、c均為含Al化合物);
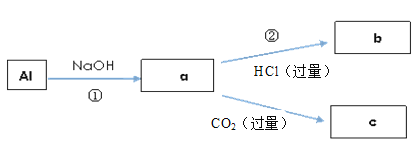
a:__________,b:___________,c:__________;①________;
(4)取一定量的FeCl3,分裝在兩支試管中。請回答:
a.若向其中一支試管中滴加KSCN溶液,則溶液變成________色。
b.向另一支試管中滴加NaOH溶液,反應的離子方程式是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“綠色”和“生態文明”是未來的發展主題,而CO2的有效利用可以緩解溫室效應,解決能源短缺問題。
(1)CO2與CH4經催化重整,制得合成氣:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
已知:反應1 CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
反應2 2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
則該催化重整反應的△H=___kJmol-1。
(2)有科學家提出可利用FeO吸收CO2:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s),對該反應的描述正確的是__。
2Fe3O4(s)+C(s),對該反應的描述正確的是__。
A.增大FeO的投入量,利于平衡正向移動
B.壓縮容器體積,可增大CO2的轉化率,c(CO2)減小
C.恒溫恒容下,氣體的密度不變可作為平衡的標志
D.恒溫恒壓下,氣體摩爾質量不變可作為平衡的標志
E.若該反應的△H﹤0,則達到化學平衡后升高溫度,CO2的物質的量會增加
(3)為研究CO2與CO之間的轉化,讓一定量的CO2與足量碳在體積可變的密閉容器中反應:C(s)+CO2(g)![]() 2CO(g) H,測得壓強、溫度對CO的體積分數[φ(CO)%]的影響如圖所示,回答下列問題:
2CO(g) H,測得壓強、溫度對CO的體積分數[φ(CO)%]的影響如圖所示,回答下列問題:
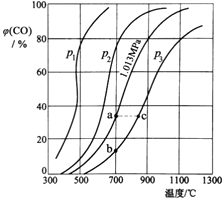
①圖中p1、p2、p3的大小關系是______,圖中a、b、c三點對應的平衡常數Ka、Kb、Kc的大小關系是______。
②900℃、1.013MPa時,1molCO2與足量碳反應達平衡后容器的體積為VL,CO2的轉化率為___(保留一位小數),該反應的平衡常數K=___。
③將②中平衡體系溫度降至640℃,壓強降至0.1013MPa,重新達到平衡后CO2的體積分數為50%。條件改變時,正反應速率______逆反應速率(填“>”、“<”或“=”)。
(4)在NaOH溶液中通入一定量的CO2氣體,所得溶液中c(HCO3-):c(CO32-)=4:1,此時溶液pH=______。(已知:室溫下,H2CO3的k1=4×10-7,k2=5×10-11。lg2=0.3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的幾種。
中的幾種。
①若加入鋅粒,用排空氣法收集到無色無味氣體;②若加入NaOH溶液,產生白色沉淀,且產生的沉淀量與加入NaOH的物質的量之間的關系如圖所示。則下列說法不正確的是( )
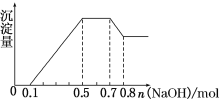
A.溶液中的陽離子有H+、Mg2+、Al3+、![]()
B.溶液中n(Mg2+)=0.1 mol
C.溶液中一定不含![]() 、
、![]() 、Fe3+
、Fe3+
D.n(![]() ∶n(Al3+)∶n(Mg2+)=4∶2∶1
∶n(Al3+)∶n(Mg2+)=4∶2∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅、鎵、硒、硅等元素的化合物是生產第三代太陽能電池的重要材料。請回答:
(1)基態銅原子的電子排布式為_______________;已知高溫下CuO→Cu2O+O2,從銅原子價層電子結構(3d和4s軌道上應填充的電子數)變化角度來看,能生成Cu2O的原因是_________________________。
(2)硒、硅均能與氫元素形成氣態氫化物,則它們形成的組成最簡單的氫化物中,分子構型分別為____________,若“Si—H”中共用電子對偏向氫元素,氫氣與硒反應時單質硒是氧化劑,則硒與硅的電負性相對大小為Se____Si(填“>”、“<”)。
(3)SeO2常溫下白色晶體,熔點為340~350℃,315℃時升華,則SeO2固體的晶體類型為_________;若SeO2類似于SO2是V型分子,則Se原子外層軌道的雜化類型為_________。
(4)與鎵元素處于同一主族的硼元素具有缺電子性(價電子數少于價層軌道數),其化合物可與具有孤對電子的分子或離子生成配合物,如BF3能與NH3反應生成BF3·NH3。BF3·NH3中B原子的雜化軌道類型為______,B與N之間形成_________鍵。
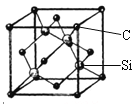
(5)金剛砂(SiC)的硬度為9.5,其晶胞結構如圖所示;則金剛砂晶體類型為________,在SiC中,每個C原子周圍最近的C原子數目為___個;若晶胞的邊長為a pm,則金剛砂的密度表達式為_________g/cm3。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com