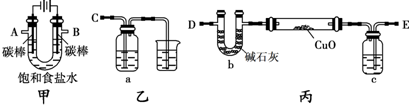
解:(1)D裝置中電解飽和食鹽水生成氫氧化鈉、氯氣、氫氣,反應離子方程式為2Cl
-+2H
2O

2OH
-+H
2↑+Cl
2↑,
故答案為:2Cl
-+2H
2O

2OH
-+H
2↑+Cl
2↑;
(2)檢驗氯氣的氧化性,應選擇還原性物質,且反應現象明顯.
A.氯氣氧化碘化鉀,生成碘單質,溶液變藍色,故A正確;
B.酸性KMnO
4溶液,具有強氧化性,故B錯誤;
C.氯氣氧化FeCl
2生成氯化鐵,溶液變黃色,故C正確;
D.氯氣氧化Na
2S生成硫,溶液變渾濁,故D正確;
故選:ACD;
(3)氯氣有毒,污染環境,F裝置的目的是吸收未反應的氯氣,防止污染大氣,故答案為:吸收未反應的氯氣;
(4)①氫氣是可燃性氣體,與氧氣混合,加熱容易發生爆炸危險,加熱氧化銅之前要通入氫氣排盡裝置內空氣,
故答案為:通入氫氣排盡裝置內空氣;
②由裝置圖與實驗原理可知,裝置A用于吸收反應產生的水,根據水的質量確定氧化銅中氧元素的質量,且A中盛放的為液體,應為濃硫酸,
故答案為:濃硫酸;
③氧化銅的質量為(b-a)g,反應后銅的質量為(c-a)g,故氧化銅中氧元素的質量為(b-a)g-(c-a)g=(b-c)g,令銅的相對原子質量為x,則x:16=(c-a)g:(b-c)g,解得x=

,故答案為:

.
分析:(1)D裝置中電解飽和食鹽水生成氫氧化鈉、氯氣、氫氣,注意反應條件“通電”;
(2)檢驗氯氣的氧化性,應選擇還原性物質,且反應現象明顯;
(3)氯氣有毒,污染環境,F裝置的目的是吸收未反應的氯氣,防止污染大氣;
(4)①氫氣是可燃性氣體,與氧氣混合,加熱容易發生爆炸危險,加熱氧化銅之前要通入氫氣排盡裝置內空氣;
②由裝置圖與實驗原理可知,裝置A用于吸收反應產生的水,根據水的質量確定氧化銅中氧元素的質量,且A中盛放的為液體,應為濃硫酸;
③氧化銅的質量為(b-a)g,反應后銅的質量為(c-a)g,故氧化銅中氧元素的質量為(b-a)g-(c-a)g=(b-c)g,利用化學式中元素的質量之比等于總的相對原子質量之比計算銅的相對原子質量.
點評:本題考查學生對實驗原理的理解、物質組成的測定等,難度中等,理解原理是關鍵,需要學生具有扎實的基礎知識與綜合運用知識分析解決問題的能力.

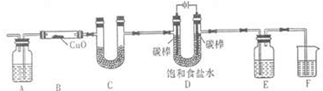 某化學小組擬采用如下裝置(夾持和加熱儀器已略去)來電解飽和食鹽水,并用電解產生的H2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性.
某化學小組擬采用如下裝置(夾持和加熱儀器已略去)來電解飽和食鹽水,并用電解產生的H2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性. 2OH-+H2↑+Cl2↑,
2OH-+H2↑+Cl2↑, 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑; ,故答案為:
,故答案為: .
.

 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案 某化學小組擬采用如下裝置(夾持和加熱儀器已略去)來電解飽和食鹽水,并用電解產生的H2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性.
某化學小組擬采用如下裝置(夾持和加熱儀器已略去)來電解飽和食鹽水,并用電解產生的H2還原CuO粉末來測定Cu的相對原子質量,同時檢驗氯氣的氧化性.