
| A. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| B. | 氧化鈉投入水中發生反應:O2-+H2O═2OH- | |
| C. | 硝酸銀溶液中加入銅粉:Ag++Cu═Cu2++Ag | |
| D. | 金屬鐵溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
科目:高中化學 來源: 題型:選擇題
| A. | ag C2H4和C3H6的混合物所含原子總數為$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-離子數為NA | |
| C. | 10 mL質量分數為98%的H2SO4,用水稀釋至100 mL,H2SO4的質量分數為9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子數大于0.6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
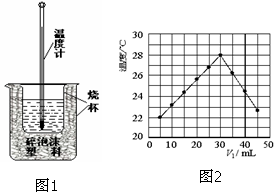 用稀鹽酸與稀NaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
用稀鹽酸與稀NaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該硫酸試劑的物質的量濃度為18.4 | |
| B. | 該硫酸與等體積的水混合所得溶液的質量分數小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取該硫酸12.5mL | |
| D. | 2.4gMg與足量的該硫酸反應得到H2 的體積為2.24L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化學鍵形成時要釋放出的能量/kJ | 436 | 946 | a |
| A. | 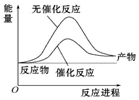 如圖可表示合成氨過程中的能量變化 | |
| B. | a的數值為391 | |
| C. | Q1的數值為92 | |
| D. | 相同條件下,反應物若為2 mol N2和6 mol H2,放出熱量Q2>2Q1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
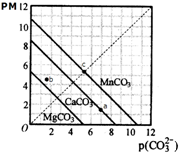
| A. | a點可表示CaCO3的飽和溶液,且c(Ca2+)<c(CO32-) | |
| B. | b點可表示MgCO3的不飽和溶液,且c(Mg2+)>c(CO32-) | |
| C. | c可表示MnCO3的飽和溶液,且c(Mn2+)=c(CO32-) | |
| D. | MgCO3、CaCO3、MnCO3的Ksp依次增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 200 | 250 | 300 | 350 |
| 平衡常數K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com