
【題目】乙酸乙酯是重要的有機物。某化學興趣小組對乙酸乙酯的制取進行探究活動。
[查閱資料]乙酸乙酯:無色、有芬芳氣味的液體,沸點77℃,熔點-83.6℃,密度0.901g/cm3,溶于乙醇、氯仿、乙醚和苯等,微溶于水,在飽和碳酸鈉中溶液溶解度更小,比水輕。

[反應原理]
CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
[實驗探究]某化學興趣小組設計如圖裝置進行實驗。在大試管a內加入碎瓷片后,加入10mL乙醇,邊振蕩邊加入5mL98%的濃H2SO4,冷卻后再加入8mL冰醋酸,點燃酒精燈緩慢加熱,將產生的蒸氣經導管通入到試管b中的的飽和Na2CO3溶液的液面上,觀察現象。
[問題討論]
(1)試管a內加入碎瓷片的作用_______(填“防止暴沸”或“防止倒吸”);
(2)試管b中長導管沒有伸入飽和Na2CO3溶液的原因是_______(填“防止暴沸”或“防止倒吸”);
(3)實驗中飽和碳酸鈉溶液的作用是_______________;
A.中和乙酸和乙醇
B.加速酯的生成,提高其產率
C.溶解乙醇,中和乙酸,降低乙酸乙酯的溶解,有利于分層析出。
(4)反應結束后試管b中的現象是_______;
A.溶液不分層
B.溶液分層,無色油狀液體在上層
C.溶液分層,無色油狀液體在下層
(5)若用9.2g乙醇與足量的冰醋酸反應,分離得到純乙酸乙酯13.2g,反應的產率是________。
【答案】防止暴沸 防止倒吸 C B 75.0%
【解析】
(1)碎瓷片有許多小孔,每一個小孔都是一個沸騰中心;
(2)乙酸乙酯中含有乙醇和乙酸,二者都是與水互溶的,易引起倒吸。
(3)飽和碳酸鈉能夠吸收未反應的乙醇、乙酸,且乙酸乙酯在飽和碳酸鈉溶液中的溶解度較小;
(4)乙酸乙酯是難溶于水、密度比水小、有香味的油狀液體;
(5)根據乙醇的質量計算乙酸乙酯的理論產量,產率=![]() ×100%。
×100%。
(1)碎瓷片有許多小孔,每一個小孔都是一個沸騰中心,試管a內加入碎瓷片的作用是防止暴沸;
(2)乙酸乙酯蒸氣中含有乙醇和乙酸,二者都是與水互溶的,易引起倒吸,所以試管b中的導管不插入液面下的原因是防止倒吸。
(3)試管b中飽和Na2CO3的作用是①中和乙酸,② 溶解乙醇,③降低酯在水中的溶解度,有利于分層析出,故選C;
(4)乙酸乙酯是難溶于水、密度比水小、有香味的油狀液體,反應完畢后,振蕩試管b,觀察到的現象是溶液分層,上層是無色油狀有香味的液體,選B;
(5)設9.2g乙醇生成乙酸乙酯的理論產量是xg,
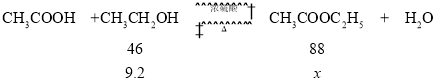
![]() =
=![]() ,解得x=17.6,產率=
,解得x=17.6,產率=![]() ×100%=75%。
×100%=75%。


科目:高中化學 來源: 題型:
【題目】氨氮是水體中氮的主要形態之一,氨氮含量過高對水中生物會構成安全威脅。
(1)一定條件下,水中的氨氮可以轉化為氮氣而除去。
已知:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=b kJ·mol-1
5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
則4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1。
(2)實驗室用電解法模擬處理氨氮廢水。電解時,不同氯離子濃度對溶液中剩余氨氮濃度的影響如圖所示。增大氯離子濃度可使氨氮去除率____(填“增大”、“減小”或“不變”),其原因是陽極生成強氧化性氣體,則陽極電極反應為_______。

(3)化學沉淀法是一種處理高濃度氨氮廢水的有效方法。通過加入MgCl2和Na2HPO4將NH4+轉化為MgNH4PO4·6H2O沉淀除去。25 ℃時,在氨氮初始質量濃度400 mg·L-1、n(Mg)∶n(P)∶n(N)=1∶1∶1的條件下,溶液pH對氨氮去除率及剩余氨氮濃度和總磷濃度的影響如圖所示。
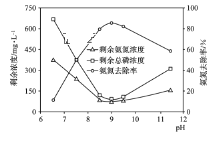
①反應生成MgNH4PO4·6H2O沉淀的離子方程式為______________。
②該實驗條件下,控制溶液的適宜pH范圍為________;當pH>9時,溶液中總磷濃度隨pH增大而增大的主要原因是_________(用離子方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年夏季奧運會將在“足球王國”——巴西首都里約熱內盧舉行,下圖酷似奧林匹克旗中的五環的一種有機物被稱為奧林匹克烴,下列說法中正確的是( )
![]()
A.該有機物屬于芳香族化合物,是苯的同系物
B.該有機物是只含非極性鍵的非極性分子
C.該有機物的一氯代物只有一種
D.該有機物完全燃燒生成H2O的物質的量小于CO2的物質的量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知溶液中只存在OH-、H+、Na+、CH3COO-四種離子,試回答下列問題:
(1)若溶液中只溶解了一種溶質,則該溶質是___________,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),則該溶液中的溶質為_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),則該溶液中溶質為_________________。
(3)若該溶液是由體積相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,則混合前c(NaOH)__________c(CH3COOH),混合前堿中c(OH-)和酸中c(H+)的關系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修3:物質結構與性質】
綠柱石被國際珠寶界公認為四大名貴寶石之一。主要成分為Be3Al2[Si6O18],因含適量的Cr2O3(0.15~0.6%),而形成祖母綠。試回答下列問題:
(1)基態Al原子中,電子填充的最高能級是_______,基態Cr原子的價電子排布式是_____。
(2)用“>”或“<”填空:
第一電離能 | 鍵能 | 沸點 | 離子半徑 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空間構型是______,它的二聚體Be2Cl4結構如右圖所示,其中Be原子的雜化方式是_____。
![]()

(4)強還原劑LiAlH4能將SiCl4還原成SiH4,試寫出SiH4在空氣中自燃的化學方程式______。
(5)Be的氧化物的立方晶胞結構如右圖所示,已知氧化鈹晶體的密度為ρg·cm-3,則晶胞連長為___cm(設NA為阿伏加德羅常數的值,用含NA、ρ的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷和甲醇可以做燃料電池,具有廣闊的開發和應用前景,回答下列問題。
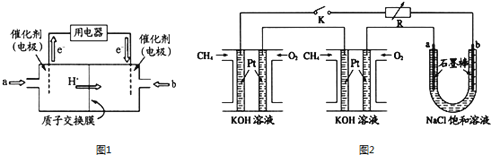
(1)甲醇燃料電池(簡稱DMFC)由于結構簡單、能量轉化率高、對環境無污染,可作為常規能源的替代品而越來越受到關注.DMFC工作原理如圖1所示:通入b氣體的電極是原電池的_________極(填“正”“負”),其電極反應式為_________________。
(2)某研究小組將兩個甲烷燃料電池串聯后作為電源,進行飽和氯化鈉溶液電解實驗,如圖2所示。閉合K后,若每個電池甲烷用量均為0.224L(標況),且反應完全,U形管中氯化鈉溶液的體積為800mL(氯化鈉足量),且在電解過程中溶液體積變化忽略不計,產生的氣體全部逸出,則在石墨電極a產生的氣體為____________(填化學式),該氣體在標況下的體積為___________。在電解后將U型管中溶液混合均勻,其pH為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.煤油可由石油分餾獲得,可用作燃料和保存少量金屬鈉
B.煤可與水蒸氣反應制成水煤氣,水煤氣的主要成分為CO和H2
C.石油裂化主要目的得到乙烯、丙烯和甲烷
D.以石油、煤和天然氣為原料,可生產塑料、合成橡膠和合成纖維
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將 4 mol A 氣體和 2 mol B 氣體在 2 L 的定容容器中混合并在一定條件下發生如下反應:2A(g)+B(g)![]() 2C(g) △H<0 ,經 2 s(秒)后測得 C 的濃度為 0. 6 mol·L-1 ,現有下列幾種說法:①用物質 A 表示的反應的平均速率為 0.3 mol·L-1s-1;②達到平衡狀態時,升高溫度,平衡逆向移動,化學平衡常數K減小;③2 s 時物質 A 的轉化率為70% ;④達平衡時,增加A物質的量,平衡正向移動,A的轉化率降低;⑤當B和C的生成速率相等時,該反應達到平衡狀態。其中不正確的是( )
2C(g) △H<0 ,經 2 s(秒)后測得 C 的濃度為 0. 6 mol·L-1 ,現有下列幾種說法:①用物質 A 表示的反應的平均速率為 0.3 mol·L-1s-1;②達到平衡狀態時,升高溫度,平衡逆向移動,化學平衡常數K減小;③2 s 時物質 A 的轉化率為70% ;④達平衡時,增加A物質的量,平衡正向移動,A的轉化率降低;⑤當B和C的生成速率相等時,該反應達到平衡狀態。其中不正確的是( )
A.①③B.②⑤C.③⑤D.②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中華優秀傳統文化涉及到很多的化學知識。下列有關說法不正確的是![]()
![]()
A.“雨過天晴云破處”所描述的瓷器青色,來自氧化鐵
B.“火樹銀花合,星橋鐵索開”,其中的“火樹銀花”涉及到焰色反應
C.![]() 天工開物
天工開物![]() 中記載:“以硝石、硫磺為主。草木灰為輔。
中記載:“以硝石、硫磺為主。草木灰為輔。![]() 魂散驚而魄齏粉”文中提到的是火藥
魂散驚而魄齏粉”文中提到的是火藥
D.![]() 天工開物
天工開物![]() 中有如下描述:“世間絲、麻、裘、褐皆具素質
中有如下描述:“世間絲、麻、裘、褐皆具素質![]() ”文中的“裘”主要成分是蛋白質
”文中的“裘”主要成分是蛋白質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com