
【題目】氯吡格雷是一種用于抑制血小板聚集的藥物,該藥物通常以 2-氯苯甲醛為原料合成,合成路線如下:
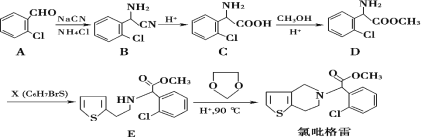
(1)下列關于氯吡格雷的說法正確的是__________。
A.氯吡格雷在一定條件下能發生消去反應
B.氯吡格雷難溶于水,在一定條件下能發生水解反應
C.1mol氯吡格雷含有5NA個碳碳雙鍵,一定條件下最多能與5molH2發生加成反應
D.氯吡格雷的分子式為C16H16ClNO2S
(2)物質 D 的核磁共振氫譜有_________種吸收峰。
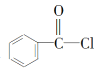
(3)物質 X 的結構簡式為____________。
(4)物質 C可在一定條件下反應生成一種含有 3個六元環的產物,寫出該反應的化學方程式______,反應類型是__________。
(5)寫出屬于芳香族化合物 A的同分異構體__________(不包含 A)。
【答案】BD 7 ![]() 2
2 +2H2O 取代反應
+2H2O 取代反應  、
、 、
、
【解析】
(1)氯吡格雷含有酯基、氯原子,可發生水解反應,含有碳碳雙鍵,可發生加成、加聚和氧化反應;
(2)D結構不對稱,有7種不同的H;
(3)對比D、E可知X的結構簡式;
(4)物質C可在一定條件下反應生成一種含有3個六元環的產物,可由2分子C發生取代反應生成;
(5)A的同分異構體可含有醛基、Cl原子以及-COCl。
(1)A.氯吡格雷中氯原子在苯環上,不能發生消去反應,故A錯誤;
B.氯吡格雷含有酯基、氯原子,難溶于水,在一定條件下能發生水解反應,故B正確;
C.lmol氯吡格雷含有2NA個碳碳雙鍵,且含有苯環,則一定條件下最多能與5molH2發生加成反應,故C錯誤;
D.由結構簡式可知氯吡格雷的分子式為C16H16ClNO2S,故D正確;
故答案為BD;
(2)D結構不對稱,有7種不同的H,則核磁共振氫譜有 7種吸收峰;
(3)對比D、E可知X的結構簡式為 ;
;
(4)物質C可在一定條件下反應生成一種含有3個六元環的產物,可由2分子C發生取代反應生成,反應的化學方程式為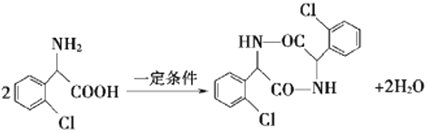 ;
;
(5)A的同分異構體可含有醛基、Cl原子以及-COCl,苯環含有2個取代基,可為鄰、間、對等位置,對應的同分異構體可能為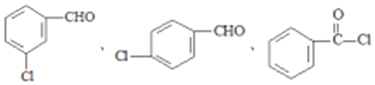 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】合成EPR橡膠(![]() )廣泛應用于防水材料、電線電纜護套、耐熱膠管等;PC塑料(
)廣泛應用于防水材料、電線電纜護套、耐熱膠管等;PC塑料(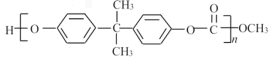 )透光性良好,可制作擋風玻璃以及眼鏡等。它們的合成路線如下:
)透光性良好,可制作擋風玻璃以及眼鏡等。它們的合成路線如下:
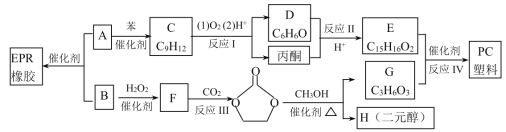
已知:①![]()
②(CH3)2C=CHCH3+H2O2![]()
![]() +H2O
+H2O
③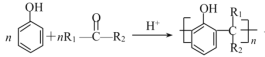 +nH2O
+nH2O
(1)A的名稱為________,反應Ⅲ的反應類型為___________,H的結構簡式為___________。
(2)在工業生產過程中,反應Ⅰ除了能得到高純度的苯酚和丙酮之外,還能回收副產物![]() 和______________。
和______________。
(3)反應Ⅱ發生時,條件控制不當有可能生成高分子化合物,其結構簡式可能是________。
(4)反應Ⅳ的化學方程式為_____________________________。
(5)有機物E滿足下列條件的同分異構體有__________種。
①含2個苯環和2個羥基,且2個羥基不能連在同一個碳上
②與FeCl3溶液不能顯紫色
③核磁共振氫譜顯示有5組峰,峰面積比為1:2:2:2:1
(6)已知: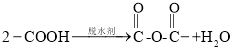 。以鄰二甲苯和苯酚為原料合成酚酞(
。以鄰二甲苯和苯酚為原料合成酚酞(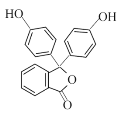 ),無機試劑任選,寫出合成路線________________。(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)
),無機試劑任選,寫出合成路線________________。(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)
查看答案和解析>>
科目:高中化學 來源: 題型:
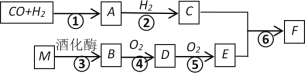
【題目】已知:A的蒸汽對氫氣的相對密度是15,且能發生銀鏡反應,F的分子式為C3H6O2。有關物質的轉化關系如下:
請回答:
(1)B中含有的官能團名稱是__________,反應⑥的反應類型為__________。
(2)寫出A發生銀鏡反應的化學方程式__________。
(3)寫出反應④的化學方程式__________。
(4)寫出有機物F與NaOH溶液反應的化學方程式__________。
(5)下列說法正確的是__________。
A 有機物D的水溶液常用于標本的防腐
B 有機物B、C、E都能與金屬鈉發生反應
C 有機物F中混有E,可用飽和碳酸鈉溶液進行分離
D 有機物M為高分子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的的是
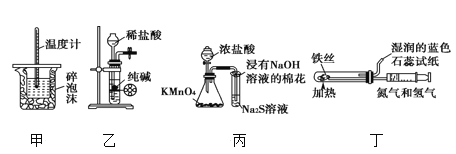
A. 用裝置甲進行中和熱的測定
B. 用裝置乙制取 CO2 氣體
C. 用裝置丙比較KMnO4、Cl2、S的氧化性強弱
D. 用裝置丁模擬工業制氨氣并檢驗產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)只用試管和膠頭滴管就可以對下列各組中的溶液進行鑒別的是_______(填序號)。
①AlCl3 溶液和 NaOH 溶液②Ca(HCO3)2 溶液和 NaOH 溶液
③NaAlO2 溶液和鹽酸④Al2(SO4)3 溶液和氨水
⑤苯與水⑥AgNO3、BaCl2、K2SO4 和 Mg(NO3)2 四種溶液
⑦NaNO3、FeCl3、NaCl、AgNO3四種溶液⑧NaHCO3 溶液與稀硫酸
(2)按以下實驗方案可從海洋物質樣品中提取具有抗腫瘤活性的天然產物。
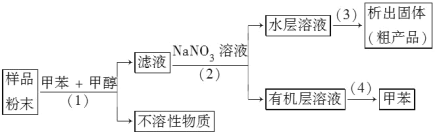
則(1)(2)(3)(4)的分離提純方法依次為__________、__________、__________、__________。
(3)下列說法正確的是_________(填序號)。
①常壓蒸餾時,加入液體的體積可超過圓底燒瓶容積的三分之二
②除去銅粉中混有 CuO 的實驗操作是加入稀硝酸溶解、過濾、洗滌、干燥
③將 Cl2 與 HCl 的混合氣體通過飽和食鹽水可得到純凈的Cl2
④用 CCl4 萃取碘水中的 I2 的實驗操作是先從分液漏斗下口放出有機層,后從上口倒出水層
⑤濾液若渾濁,可能是液面高于濾紙邊緣造成的
⑥NaCl 溶液蒸發時可以加熱至蒸干為止
⑦蒸餾時,可以把溫度計插入混合液體中
⑧可以用酒精萃取碘水中的I2。
⑨CCl4 萃取溴水中溴時,靜置分層后上層為橙紅色,分液時,從上口先倒出上層液體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 廣泛用作有機反應催化劑。十堰市采用鎂屑與液溴為原料制備無水
廣泛用作有機反應催化劑。十堰市采用鎂屑與液溴為原料制備無水![]() ,裝置如圖1,主要步驟如下:
,裝置如圖1,主要步驟如下:
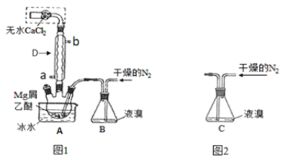
步驟1:三頸瓶中裝入10g鎂屑和150mL無水乙醚;裝置B中加入15mL液溴。
步驟2:緩慢通入干燥的氮氣,直至溴完全導入三口瓶中。
步驟3:反應完畢后恢復至室溫,過濾,濾液轉移至另一干燥的燒瓶中,冷卻至0℃,析出晶體,再過濾得三乙醚合溴化鎂粗品。
步驟4:常溫下用苯溶解粗品,冷卻至0℃,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至160℃分解得無水![]() 產品。
產品。
已知:①![]() 和
和![]() 劇烈反應,放出大量的熱;
劇烈反應,放出大量的熱;![]() 具有強吸水性;
具有強吸水性;
②乙醚![]() 極易揮發;
極易揮發;
③![]()
![]()
請回答下列問題:
(1)儀器D的作用是__________;
(2)無水![]() 的作用是__________。
的作用是__________。
(3)步驟2通入干燥的![]() 的目的是______;實驗中不能用干燥空氣代替干燥
的目的是______;實驗中不能用干燥空氣代替干燥![]() ,原因是________。
,原因是________。
(4)若將裝置B改為裝置C(圖2),可能會導致的后果是______
(5)步驟4用苯溶解粗品的目的是_________。
(6)從平衡移動的角度解釋得到三乙醚合溴化鎂后,加熱有利于得到無水![]() 產品的原因:_________
產品的原因:_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業上可由天然二氧化錳粉與硫化錳礦(還含Fe、Al、Mg、Zn、Ni、Si等元素)制備,工藝如下圖所示。回答下列問題:

相關金屬離子[c0(Mn+)=0.1 mol·L1]形成氫氧化物沉淀的pH范圍如下:
金屬離子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
開始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“濾渣1”含有S和__________________________;寫出“溶浸”中二氧化錳與硫化錳反應的化學方程式____________________________________________________。
(2)“氧化”中添加適量的MnO2的作用是將________________________。
(3)“調pH”除鐵和鋁,溶液的pH范圍應調節為_______~6之間。
(4)“除雜1”的目的是除去Zn2+和Ni2+,“濾渣3”的主要成分是______________。
(5)“除雜2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度過高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)寫出“沉錳”的離子方程式___________________________________________________。
(7)層狀鎳鈷錳三元材料可作為鋰離子電池正極材料,其化學式為LiNixCoyMn![]() 時,z=___________。
時,z=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C為短周期元素,在周期表中所處的位置如圖所示。A、C兩元素的原子核外電子數之和等于B原子的質子數。B原子核內質子數和中子數相等。

(1)寫出元素A的名稱:______________,C在元素周期表中的位置是______________。
(2)B的原子結構示意圖為______________,C的氫化物與B的氫化物的穩定性強弱順序為______________。
(3)比較A、C的原子半徑:A______________(填“>”或“<”)C。寫出A的氣態氫化物與A的最高價氧化物對應的水化物反應的化學方程式:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一混合物的水溶液,可能含有以下離子中的幾種:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,現取三份各100 mL溶液進行如下實驗: 第一份加入AgNO3溶液有沉淀產生;第二份加足量NaOH溶液加熱后,收集到0.08 mol氣體;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,經足量鹽酸洗滌、干燥后,沉淀質量為4.66 g。以下結論正確的是( )
A.該混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-
B.該混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.該混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.該混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com