
通常人們把拆開1 mol某化學鍵所吸收的能量看成該化學鍵的鍵能。鍵能的大小可以衡量化學鍵的強弱,也可用于估算化學反應的反應熱(ΔH),化學反應的ΔH等于反應中斷裂舊化學鍵的鍵能之和與反應中形成新化學鍵的鍵能之和的差。
化學鍵 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
鍵能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
請回答下列問題:
(1)比較下列兩組物質的熔點高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。
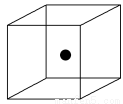
(2)下圖立方體中心的“●”表示硅晶體中的一個原子,請在立方體的頂點用“●”表示出與之緊鄰的硅原子。
(3)工業上高純硅可通過下列反應制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)該反應的反應熱ΔH=________ kJ·mol-1。
Si(s)+4HCl(g)該反應的反應熱ΔH=________ kJ·mol-1。
(1)> <
(2)如下圖

(3)236
【解析】(1)SiC和晶體Si皆為原子晶體,由于碳化硅晶體中的Si—C鍵的鍵能大于硅晶體中Si—Si鍵的鍵能,故SiC的熔點比Si高;SiCl4為分子晶體,SiO2為原子晶體,故SiCl4的熔點比SiO2低。
(2)晶體硅的結構與金剛石相似,每個硅原子都被相鄰的4個硅原子包圍,這4個硅原子位于四面體的四個頂點上,被包圍的硅原子處于正四面體的中心。
(3)根據題目所給反應式,需要斷裂的舊化學鍵鍵能之和為4×360 kJ·mol-1+2×436 kJ·mol-1=2 312 kJ·mol-1,形成的新化學鍵鍵能之和為4×431 kJ·mol-1+2×176 kJ·mol-1=2 076 kJ·mol-1,所以ΔH=236 kJ·mol-1。


 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案 一課一練一本通系列答案
一課一練一本通系列答案 浙江之星學業水平測試系列答案
浙江之星學業水平測試系列答案科目:高中化學 來源:2014年高二魯科選修3化學規范訓練2.4分子間作用力物質性質練習卷(解析版) 題型:簡答題
在下列各組氣體中,試分析判斷哪種氣體更易液化?
①Cl2、N2;②SiH4、CH4;③SO2、CO2;④鄰二甲苯、對二甲苯;⑤甲烷、乙烷;⑥丁烷、異丁烷
查看答案和解析>>
科目:高中化學 來源:2014年高二魯科版選修3化學規范訓練2章化學鍵分子間作用力練習卷(解析版) 題型:選擇題
下列有關共價鍵的敘述中,不正確的是( )。
A.某原子跟其他原子形成共價鍵時,其共價鍵數一定等于該元素原子的價電子數
B.水分子內氧原子結合的電子數已經達到飽和,故不能再結合其他氫原子
C.非金屬元素原子之間形成的化合物也可能是離子化合物
D.所有簡單離子的核電荷數與其核外電子數一定不相等
查看答案和解析>>
科目:高中化學 來源:2014年高二魯科版選修3化學規范訓練2.2.1典型分子空間構型練習卷(解析版) 題型:選擇題
如圖在乙烯分子中有5個σ鍵、一個π鍵,它們分別是( )。
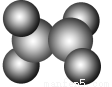
A.sp2雜化軌道形成σ鍵、未雜化的2p軌道形成π鍵
B.sp2雜化軌道形成π鍵、未雜化的2p軌道形成σ鍵
C.C—H之間是sp2形成的σ鍵,C—C之間是未參加雜化的2p軌道形成的π鍵
D.C—C之間是sp2形成的σ鍵,C—H之間是未參加雜化的2p軌道形成的π鍵
查看答案和解析>>
科目:高中化學 來源:2014年高二魯科版選修3化學規范訓練 3.3原子晶體與分子晶體練習卷(解析版) 題型:選擇題
下列化合物按其晶體的熔點由高到低排列正確的是( )。
A.SiO2 CsCl CBr4 CF4
B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4
D.CF4 CBr4 CsCl SiO2
查看答案和解析>>
科目:高中化學 來源:2014年高二魯科版選修3化學規范訓練 3.2金屬晶體與離子晶體練習卷(解析版) 題型:填空題
今有aX、bY、cZ三種元素。已知:①各原子序數a、b、c均小于20且a+b+c=25;②元素Y的原子外圍電子構型為ns2npn+2;③X和Y在不同條件下可形成X2Y和X2Y2兩種化合物,Y和Z在不同條件下可形成ZY和ZY2兩種化合物;④Z的硫化物的相對分子質量與Z的氯化物的相對分子質量之比為38∶77,據上可推知:
(1)X________,Y________,Z________(寫元素符號)。
(2)X2Y2是________晶體,構成晶體的微粒是________,該晶體中含有________(填其微粒間作用)。
(3)Z的硫化物和氯化物的分子空間構型分別是__________、________,其中Z原子分別以________、________雜化軌道成鍵,按照成鍵方式來分類,Z的硫化物中的共價鍵類型和數目是___________________________________。
查看答案和解析>>
科目:高中化學 來源:2014年高二魯科版選修3化學規范訓練 3.2金屬晶體與離子晶體練習卷(解析版) 題型:選擇題
下列有關金屬鍵的敘述錯誤的是( )。
A.金屬鍵沒有飽和性和方向性
B.金屬鍵是金屬陽離子和自由電子之間存在的強烈的靜電吸引作用
C.金屬鍵中的電子屬于整塊金屬
D.金屬的性質和金屬固體的形成都與金屬鍵有關
查看答案和解析>>
科目:高中化學 來源:2014年高二魯科版選修3化學規范訓練 2.1.2鍵參數練習卷(解析版) 題型:選擇題
已知1 g氫氣完全燃燒生成水蒸氣時放出熱量121 kJ,且氧氣中1 mol O=O鍵完全斷裂時吸收熱量496 kJ,水蒸氣中1 mol H—O鍵形成時放出熱量463 kJ,則氫氣中1 mol H—H鍵斷裂時吸收熱量為( )。
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化學 來源:2014年高二化學蘇教版選修2 6專題綜合檢測練習卷(解析版) 題型:填空題
鋅錳廢電池經處理后,生產并回收硫酸鋅及碳酸錳,其中生產工業級碳酸錳工藝如下:
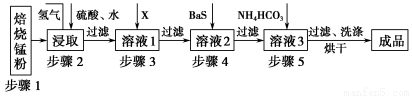
試回答下列問題:
(1)錳在元素周期表中位于第________周期,第________族。
(2)步驟1和步驟2是將MnO2轉化為MnO并溶于硫酸,其中步驟2中的氫氣,是另一個流程產生的副產品,請寫出產生氫氣的反應方程式__________________________。
(3)步驟3和步驟4都是除雜質。
①X是一種“綠色”氧化劑,則X是________(填化學式)。
②步驟3是除去雜質Fe2+。請用文字和必要的方程式簡述除去Fe2+的方法(已知三種離子沉淀的pH范圍為Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步驟4中主要反應方程式為:MeSO4+BaS=MeS↓+BaSO4↓(Me主要為Pb、Cd、Hg等),則其除去雜質的原理是_________________________________________________。
(4)已知進行步驟5的操作時,溶液3(主要成分為MnSO4)會產生大量無色無味的氣泡,則步驟5反應的化學方程式為_______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com