
(10 分)已知:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
4NO+3O2+2H2O 4HNO3
4HNO3
設空氣中氧氣的體積分數為0.20,氮氣體積分數為0.80,請完成下列填空:
(1)amol NO完全轉化為HNO3需要空氣______mol;
(2)為使NH3恰好完全氧化為一氧化氮,氨-空氣混合物中氨的體積分數為_______(保留2位小數)。
(3)20.0moL的NH3用空氣氧化,產生混合物的組成為:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量的硝酸,以及其它成分。(高溫下NO和O2不反應)
計算氨轉化為NO和HNO3的轉化率。
(1)3.75a mol 2分
(2)0.14 2分
(3)設生成x mol HNO3 4(2x+18.0×5/4+12.0)=150.0 x=1.5(mol)
NH3的轉化為HNO3的轉化率=(1.5/20.0)×100%=7.5% 3分
NH3的轉化為NO的轉化率=(18.0+1.5)/20.0×100%=97.5% 3分
解析試題分析:
(1)amol NO需要反應的O2為0.75a mol,而空氣為0.75a×5="3.75a" mol;
(2)若有1mol的氨氣反應,則需要氧氣為1.25mol,相應需要的空氣為5mol,所以氨氣與空氣混合后,氨氣的體積分數為14%。
(3)150mol的氮氣所處的空氣中,有37.5mol的氧氣。設生成的硝酸為x mol,則生成硝酸所需的一氧化氮為x mol,需要的氧氣為0.75x mol;而生成所有一氧化氮(18+x)mol的氧氣需要1.25×(18+x)mol,所以0.75x +1.25×(18+x)+12=37.5,得x=1.5mol。NH3的轉化為HNO3的轉化率=(1.5/20.0)×100%=7.5%,而NH3的轉化為NO的轉化率=(18.0+1.5)/20.0×100%=97.5% 。
考點:氣體體積分數的計算,反應物轉化率的計算
點評:本題涉及到的計算比較簡單,最后一問在計算時要注意,氨氣未反應完,有一定的轉化率。


科目:高中化學 來源: 題型:
(本小題滿分10分)已知A 是一種相對分子質量為28的氣態(tài)烴,現以A為主要原料合成一種具有果香味的物質E,其合成路線如下圖所示。已知B、D是廚房常用調味劑。

請回答下列問題:
(1)寫出A的結構簡式 。
(2)B、D分子中的官能團名稱分別是 、 。
(3)物質A可以被直接氧化為D,其化學方程式可表示為 。
(4)寫出下列反應的化學方程式
② ;
④ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
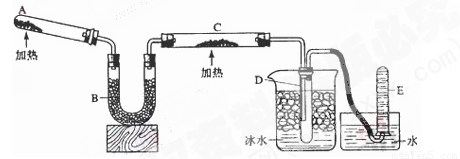
(共10分)已知氨可以與灼熱的氧化銅反應得到氮氣和金屬銅,反應方程式為2NH3+3CuO
![]() N2+3H2O+3Cu,用示意圖中的裝置可以實現該反應。回答下列問題:
N2+3H2O+3Cu,用示意圖中的裝置可以實現該反應。回答下列問題:
(1)A中發(fā)生反應的化學方程式是 。檢驗氨氣通常采用的方法及現象是_________ ____________, 。
(2)B中加入的物質是 ,其作用是 。
(3)實驗時C中觀察到的現象是 ,該反應中氨的作用是_______劑。
(4)若要檢驗反應生成的水,可將試管D及燒杯部分改成兩個相連的干燥管,第一個干燥管X內裝有_____________,現象是___________________;第二個干燥管Y內裝有堿石灰,作用是____________________________。
查看答案和解析>>
科目:高中化學 來源:2014屆江蘇省高一第一學期期中考試化學試卷 題型:填空題
(本小題滿分10分)已知A 是一種相對分子質量為28的氣態(tài)烴,現以A為主要原料合成一種具有果香味的物質E,其合成路線如下圖所示。已知B、D是廚房常用調味劑。

請回答下列問題:
(1)寫出A的結構簡式 。
(2)B、D分子中的官能團名稱分別是 、 。
(3)物質A可以被直接氧化為D,其化學方程式可表示為 。
(4)寫出下列反應的化學方程式
② ;
④ 。
查看答案和解析>>
科目:高中化學 來源:2014屆山東省濟寧市高一3月月考化學試卷 題型:實驗題
(共10分)已知氨可以與灼熱的氧化銅反應得到氮氣和金屬銅,反應方程式為2NH3+3CuO
 N2+3H2O+3Cu,用示意圖中的裝置可以實現該反應。回答下列問題:
N2+3H2O+3Cu,用示意圖中的裝置可以實現該反應。回答下列問題:
(1)A中發(fā)生反應的化學方程式是 。檢驗氨氣通常采用的方法及現象是_________ ____________, 。
(2)B中加入的物質是 ,其作用是 。
(3)實驗時C中觀察到的現象是 ,該反應中氨的作用是_______劑。
(4)若要檢驗反應生成的水,可將試管D及燒杯部分改成兩個相連的干燥管,第一個干燥管X內裝有_____________,現象是___________________;第二個干燥管Y內裝有堿石灰,作用是____________________________。
查看答案和解析>>
科目:高中化學 來源:2009-2010江西省高二第七次月考化學試題 題型:填空題
(每空1分,共10分)
已知化合物A中各元素的質量分數分別是C:37.5%,H:4.2%和O:58.3%,請?zhí)羁眨?/p>
(1)0.01mol A在空氣中充分燃燒需消耗氧氣1.01L(標準狀況),則A的分子式是 ;
(2)實驗表明:A不能發(fā)生銀鏡反應。1 mol A與足量的碳酸氫鈉溶液反應可以放出3 mol CO2。在濃硫酸催化下,A與乙酸可發(fā)生酯化反應。核磁共振氫譜表明A分子中有4個氫處于完全相同的化學環(huán)境,則A的結構簡式是 ;
(3)在濃硫酸催化和適宜的的反應條件下,A與足量的乙醇反應生成B(C12H20O7),B只有兩種官能團,其數目比為3∶1,則由A生成B的反應類型是 ,該反應的化學方程式是 ;
(4)A失去1分子水后形成化合物C,寫出C的兩種可能的結構簡式及其官能團的名稱:① , , ;
② , , 。
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com