
 室溫下,將0.10mol•L-1鹽酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH隨加入鹽酸體積變化曲線如圖所示.已知:pOH=-lg c(OH-),下列說法正確的是( )
室溫下,將0.10mol•L-1鹽酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH隨加入鹽酸體積變化曲線如圖所示.已知:pOH=-lg c(OH-),下列說法正確的是( )| A. | M點所示溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | N點所示溶液中c(NH4+)>c(Cl-) | |
| C. | Q點消耗鹽酸的體積等于氨水的體積 | |
| D. | M點和N點所示溶液中水的電離程度相同 |
分析 由于Kw=(H+)×c(OH-)=10-14,則溶液的pH+pOH=14,實線為pH曲線,虛線為pOH曲線,作垂直體積坐標軸線與pH曲線、pOH曲線交點為相應溶液中pH、pOH.Q點的pH=pOH,則Q點溶液呈中性.
A.M點溶液呈堿性,為NH4Cl、NH3•H2O混合溶液;
B.N點溶液呈酸性,溶液中(H+)>c(OH-),結合電荷守恒判斷;
C.恰好反應得到NH4Cl溶液呈酸性,Q點溶液呈中性,氨水稍過量;
D.M點溶液中氫離子源于水的電離,N點氫氧根離子源于水的電離,而M點氫離子濃度與N點氫氧根離子濃度相等.
解答 解:由于Kw=(H+)×c(OH-)=10-14,則溶液的pH+pOH=14,實線為pH曲線,虛線為pOH曲線,作垂直體積坐標軸線與pH曲線、pOH曲線交點為相應溶液中pH、pOH.Q點的pH=pOH,則Q點溶液呈中性.
A.M點溶液呈堿性,為NH4Cl、NH3•H2O混合溶液,溶液中c(NH4+)+c(NH3•H2O)>c(Cl-),故A錯誤;
B.N點溶液呈酸性,溶液中(H+)>c(OH-),結合電荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),可知c(NH4+)<c(Cl-),故B錯誤;
C.恰好反應得到NH4Cl溶液呈酸性,Q點溶液呈中性,氨水稍過量,故C錯誤;
D.M點溶液中氫離子源于水的電離,N點氫氧根離子源于水的電離,而M點氫離子濃度與N點氫氧根離子濃度相等,則M、N點所示溶液中水的電離程度相同,故D正確.
故選:D.
點評 本題考查離子濃度大小比較、滴定曲線等,關鍵是理解pH與pOH關系以及與二者與溶液酸堿性關系,離子濃度等量關系比較中常考慮電荷守恒、物料守恒、質子恒等式.


科目:高中化學 來源: 題型:解答題
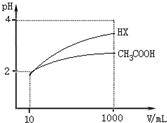 25℃時,三種酸的電離平衡常數如下:
25℃時,三種酸的電離平衡常數如下:| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
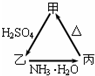 甲、乙、丙三種物質之間有如右圖所示的轉化關系:
甲、乙、丙三種物質之間有如右圖所示的轉化關系:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2 mol H2(g)和1 mol I2(g) | B. | 3 mol HI(g) | ||
| C. | 2 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
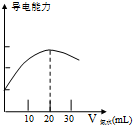 某學習小組用DIS系統測定食用白醋中醋酸的物質的量濃度,以溶液的導電能力來判斷滴定終點.實驗步驟如下:
某學習小組用DIS系統測定食用白醋中醋酸的物質的量濃度,以溶液的導電能力來判斷滴定終點.實驗步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
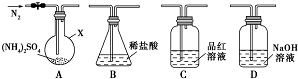
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 附著在試管內壁上的AgCl固體可用氨水溶解而洗去 | |
| B. | 可用氨水鑒別AlCl3、AgNO3和CuSO4三種溶液 | |
| C. | 向氨水中滴加CuSO4溶液至過量,先產生藍色沉淀,然后沉淀溶解并得到深藍色溶液 | |
| D. | 加熱碘單質,產生紫色蒸氣,這個過程克服了范德華力 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com