
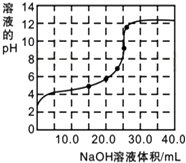
 某研究性學習小組探究醋酸的溶液情況,進行了如下實驗.
某研究性學習小組探究醋酸的溶液情況,進行了如下實驗.| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的體積(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
分析 (1)需要用到的玻璃儀器有量筒、燒杯、玻璃棒、250mL容量瓶與膠頭滴管;
(2)第3次實驗消耗NaOH溶液體積與其它3次相差比較大,應舍棄,其它3組平均值為消耗氫氧化鈉溶液體積,再結合V(NaOH)×c(NaOH)=V(醋酸)×c(醋酸)計算;
(3)①當滴加12.50mL NaOH后,溶液呈酸性,是醋酸和醋酸鈉,溶液中醋酸電離程度大于醋酸根水解程度;
②當滴加25.00mLNaOH時,與醋酸的體積相等,恰好反應為CH3COONa反應,根據氫氧根離子濃度計算;
根據氫氧根離子守恒:c(OH-)-c(CH3COOH)=c(H+).
解答 解:(1)用量取量取醋酸,在燒杯中溶解,并用玻璃棒攪拌,用玻璃棒引流移入250mL容量瓶中,最后用膠頭滴管定容,
故答案為:250mL容量瓶;膠頭滴管;
(2)第3次實驗消耗NaOH溶液體積與其它3次相差比較大,應舍棄,消耗氫氧化鈉溶液體積為25.00mL,再結合V(NaOH)×c(NaOH)=V(醋酸)×c(醋酸),可知c(醋酸)=c(NaOH)=0.2000 mol•L-1,
故答案為:0.2000 mol•L-1;
(3)①當滴加12.50mL NaOH后,溶液呈酸性,是醋酸和醋酸鈉,溶液中醋酸電離程度大于醋酸根水解程度,溶液中離子濃度:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案為:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
②當滴加25.00mLNaOH時,與醋酸的體積相等,恰好反應為CH3COONa反應,溶液中氫氧根離子源于水的電離,則混合溶液中水的電離度是純水的$\frac{\frac{1{0}^{-14}}{1{0}^{-9}}}{1{0}^{-7}}$=100倍,
根據氫氧根離子守恒:c(OH-)-c(CH3COOH)=c(H+)=10-9mol/L,
故答案為:100;10-9.
點評 本題考查一定物質的量濃度溶液配制、中和滴定、離子濃度大小比較等,注意電荷守恒、物料守恒、質子恒等式在離子濃度等量關系比較中應用.


科目:高中化學 來源: 題型:選擇題
| A. | 若pH>7時,則一定是C1V1>C2V2 | |
| B. | 若pH<7時,混合溶液中可能有c(Na+)>c(H+) | |
| C. | 當pH=7時,若V1=V2,則一定是C2=C1 | |
| D. | 若 V1=V2,C1=C2,則c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將SO2通入品紅溶液,溶液褪色后加熱恢復原色;將SO2通入溴水,溴水褪色后加熱也能恢復原色 | |
| B. | 乙酸乙酯的制備實驗中,飽和Na2CO3溶液不僅可以降低乙酸乙酯的溶解度,還能吸收揮發出來的乙醇及乙酸 | |
| C. | “中和滴定”實驗中,容量瓶和錐形瓶用蒸餾水洗凈后即可使用,滴定管和移液管用蒸餾水洗凈后,必須干燥或潤洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可將混合氣體依次通過盛有酸性KMnO4溶液、濃硫酸的洗氣瓶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
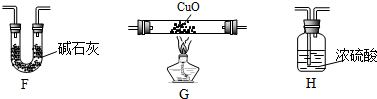
| 裝置 | 實驗前的質量/g | 實驗后的質量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 微粒半徑:K+>Al3+>S2->Cl- | B. | 離子的還原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金屬性:K>Ca>Mg>Be |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 呈中性 | B. | 呈堿性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 紅磷轉化為白磷,屬于物理變化 | |
| B. | 石墨導電、金剛石不導電,故二者不是同素異形體 | |
| C. | O2和O3分子式不同,結構相同 | |
| D. | 單質硫有S2、S4、S6等,它們都是硫的同素異形體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com