
| A. | 1:20 | B. | 1:2 | C. | 1:10 | D. | 10:1 |
分析 依據pH=-lg[H+],計算pH=4的硫酸溶液中,氫離子的物質的量濃度,依據H2SO4=2H++SO42-,計算硫酸根離子的濃度;稀釋10000倍,此時溶液接近中性,氫離子濃度不可能小于1×10-7mol/L,只能無限接近1×10-7mol/L,而稀釋過程中硫酸根的物質的量不變,計算稀釋后溶液中硫酸根的物質的量濃度,據此計算解答.
解答 解:由pH=-lg[H+]可知pH=4的硫酸溶液中c(H+)=1×10-4mol/L,硫酸為強電解質完全電離,氫離子濃度為硫酸根離子濃度2倍,所以c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-4mol/L=5×10-5mol/L;
溶液稀釋10000倍后,氫離子濃度不可能小于1×10-7mol/L,只能無限接近1×10-7mol/L;
硫酸根離子濃度為:c(SO42-)=5×10-5mol/L×$\frac{1}{10000}$=5×10-9mol/L,
稀釋后溶液中SO42-離子濃度與H+離子濃度與比值約為:5×10-9mol/L:1×10-7mol/L=1:20,
故選A.
點評 本題考查了有關pH值計算以及溶液的稀釋,注意掌握溶液酸堿性與溶液pH的關系,溶液稀釋過程中pH值變化的規律是解題關鍵,注意酸堿稀釋接近中性應考慮水的電離.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某溶液中滴入KSCN溶液呈紅色,說明不含Fe2+ | |
| B. | 向某溶液中加入酸性KMnO4溶液,溶液褪色,說明原溶液中一定含Fe2+ | |
| C. | 向某溶液中加入NaOH溶液,得紅褐色沉淀,說明溶液中含有Fe3+ | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又觀察到顏色逐漸變為紅褐色,說明該溶液中含有Fe2+,可能含有Mg2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
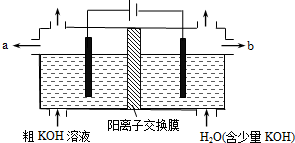 ( )
( )| A. | 陽極反應式為4OH--4e-=2H2O+O2↑ | B. | 通電后陰極區附近溶液pH會增大 | ||
| C. | K+通過交換膜從陰極區移向陽極區 | D. | 純凈的KOH溶液從b出口導出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
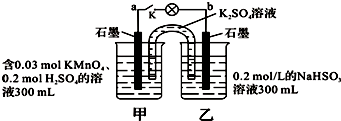
| A. | 當電路中有1.204×1022個電子轉移時,乙燒杯中溶液的C(H+)約為0.1 mol•L-1 | |
| B. | 電池工作時,鹽橋中的K+移向甲燒杯 | |
| C. | 電池工作時,外電路的電子方向是從a到b | |
| D. | 乙池中的氧化產物為SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5-3.2 | 6.4-8.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
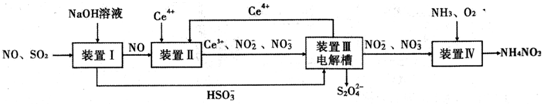
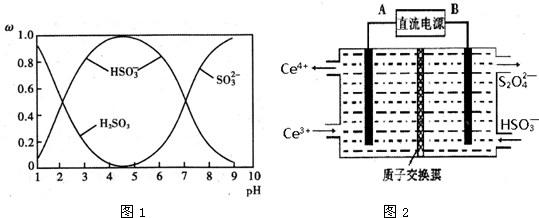
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 若b的最高價氧化物對應水化物為H2bO4,則a的氫化物的化學式為aH3 | |
| B. | 若b的單質可作半導體材料,則c的單質不可能為半導體材料 | |
| C. | 若b的單質與H2易化合,則c的單質與H2更易化合 | |
| D. | a與b之間容易形成離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ④ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com