
分析 X原子核外的M層中只有兩對成對電子,核外電子排布應為1s22s22p63s23p4,為S元素;Y原子核外的L層電子數是K層的兩倍,Y有2個電子層,最外層電子數為4,故Y為C元素;Z是地殼內含量最高的元素,為O元素;Q的核電荷數是X與Z的核電荷數之和,其原子序數為24,為Cr元素;E在元素周期表的各元素中電負性最大,應為F元素,結合元素對應單質、化合物的結構和性質解答該題.
解答 解:X原子核外的M層中只有兩對成對電子,核外電子排布應為1s22s22p63s23p4,為S元素;Y原子核外的L層電子數是K層的兩倍,Y有2個電子層,最外層電子數為4,故Y為C元素;Z是地殼內含量最高的元素,為O元素;Q的核電荷數是X與Z的核電荷數之和,其原子序數為24,為Cr元素;E在元素周期表的各元素中電負性最大,應為F元素.
(1)E為F元素,Y為C元素,Z為O元素,周期自左而右原子半徑減小,故原子半徑:C>O>F,
故答案為:C>O>F;
(2)XZ2為SO2,YZ2為CO2,SO2分子中,S和O形成2個δ鍵,有1個孤電子對,為V形.CO2分子中,C和O形成2個δ鍵,沒有孤電子對,為直線形,
SO2是極性分子,H2O也是極性分子,相似相溶,而CO2是非極性分子,故SO2在水中溶解度更大,
故答案為:V形;直線形;SO2;SO2是極性分子,H2O也是極性分子,相似相溶,而CO2是非極性分子;
(3)Q為Cr,原子序數為24,位于周期表第四周期ⅥB族,核外電子排布式為1s22s22p63s23p63d54s1,最高化合價為+6價,
故答案為:Cr;VIB;1s22s22p63s23p63d54s1;+6;
(4)碳元素的一種單質具有很高的硬度,該單質為金剛石,它的晶體類型為原子晶體,
故答案為:原子晶體.
點評 本題考查原子結構與元素的性質,題目難度中等,推斷元素的種類是關鍵,注意掌握原子核外電子排布、微粒空間構型的判斷.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 將Cl2通入NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 銅和稀硝酸的反應:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 鋼鐵吸氧腐蝕的正極反應:4OH--4e-═O2↑+2H2O | |
| D. | 將少量SO2通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
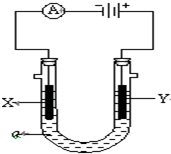 電解原理在化學工業中有廣泛應用.圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
電解原理在化學工業中有廣泛應用.圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
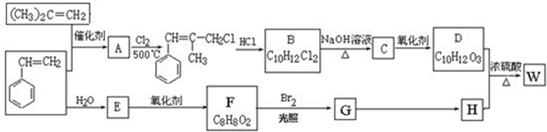

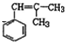 ;W的結構簡式:
;W的結構簡式: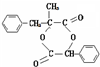 .
.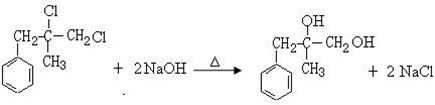 ;由D生成高分子化合物的方程式
;由D生成高分子化合物的方程式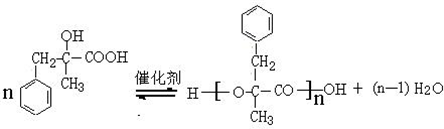 .
.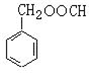 (寫結構簡式),其峰面積之比為1:2:2:2:1.
(寫結構簡式),其峰面積之比為1:2:2:2:1.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “西氣東輸”中的“氣”主要成分是甲烷 | |
| B. | 乙烯的結構簡式為CH2CH2 | |
| C. | 分子式為C6H6的物質一定是苯 | |
| D. | 乙烯使溴水褪色說明乙烯與溴發生了取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
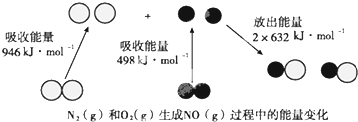
| A. | N≡N鍵的鍵能為946kJ•mol-1 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| C. | 當有16gO2(g)參加反應時,該反應吸收90kJ熱量 | |
| D. | 當有1mol電子發生轉移時,該反應吸收90kJ熱量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com