A、B、C、D、E五種短周期元素的原子序數依次增大,上述元素中只有一種金屬元素.A、B同周期,化合物AB2、DB2均是可使澄清石灰水變渾濁的氣體.又已知C、E的單質均可溶于NaOH溶液,且C與NaOH溶液反應可產生氣體.
(1)寫出D、E五種元素的名稱:A.______ B.______ C.______D.______,E.______.
(2)寫出AB2 的電子式:______
(3)寫出DB2使澄清石灰水變渾濁的化學方程式:______.
(4)寫出C、E的單質分別與NaOH溶液反應的離子方程式:______,______.
【答案】
分析:A、B同周期,化合物AB
2、DB
2均是可使澄清石灰水變渾濁的氣體,常見氣體有CO
2、SO
2,則可知A為C元素,B為O元素,D為S元素,C、E的單質均可溶于NaOH溶液,且C與NaOH溶液反應可產生氣體,原子序數介于8(O)與16(S)之間的只有Al符合,則C為Al,所以E為Cl,為原子序數最大的主族短周期元素,根據元素對應的單質、化合物的性質解答各題.
解答:解:(1)A、B同周期,化合物AB
2、DB
2均是可使澄清石灰水變渾濁的氣體,常見氣體有CO
2、SO
2,則可知A為C元素,B為O元素,D為S元素,C、E的單質均可溶于NaOH溶液,且C與NaOH溶液反應可產生氣體,原子序數介于8(O)與16(S)之間的只有Al符合,則C為Al,所以E為Cl,
故答案為:碳;氧;鋁;硫;氯;
(2)AB
2為CO
2,為共價化合物,化合物中各原子的最外層達到8電子穩定結構,電子式為
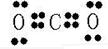
,
故答案為:
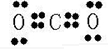
;
(3)SO
2與澄清石灰水反應生成微溶于水的CaSO
3,反應的化學方程式為SO
2+Ca(OH)
2═CaSO
3↓+H
2O,
故答案為:SO
2+Ca(OH)
2═CaSO
3↓+H
2O;
(4)Al與NaOH溶液反應生成NaAlO
2和氫氣,反應的離子方程式為2Al+2OH
-+2H
2O═2AlO
2-+3H
2↑,Cl
2在NaOH溶液自身發生氧化還原反應生成NaCl和NaClO,反應的離子方程式為
Cl
2+2OH
-═ClO
-+Cl
-+H
2O,故答案為:2Al+2OH
-+2H
2O═2AlO
2-+3H
2↑;Cl
2+2OH
-═ClO
-+Cl
-+H
2O.
點評:本題考查元素的推斷,題目難度不大,本題從物質的性質的角度入手考查元素的種類,注意常見元素化合物的性質,注重電子式以及離子方程式的書寫.

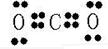 ,
,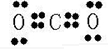 ;
;

 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案 寶貝計劃期末沖刺奪100分系列答案
寶貝計劃期末沖刺奪100分系列答案 能考試全能100分系列答案
能考試全能100分系列答案








