
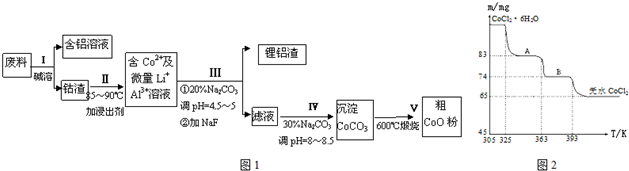
分析 操作Ⅰ利用了鋁能溶解在氫氧化鈉溶液的性質,將鋁從廢料中分離出來,過濾后得到含Co2O3•CoO的鈷渣,再用酸溶解過濾后得到含Co3+及Al3+、Li+的濾液,通過調整溶液的pH得到Al(OH)3和LiF沉淀,再過濾得到含Co3+的濾液,再滴加Na2CO3溶液得到CoCO3沉淀,經過濾、洗滌沉淀,最后將CoCO3進行加熱分解可得CoO粉末,
(1)鋁和氫氧化鈉反應生成偏鋁酸鈉和氫氣,注意該反應中水是反應物;
(2)
(3)根據鋁離子能與碳酸根離子發生雙水解生成氫氧化鋁和二氧化碳;
(4)碳酸鈉溶液在過程Ⅲ中鋁離子能與碳酸根離子發生雙水解生成氫氧化鋁和二氧化碳;碳酸鈉溶液在過程Ⅳ中調整pH,提供CO32-,使Co2+沉淀為CoCO3;
(5)根據關系式CoCl2•6H2O~CoCl2求出CoCl2•6H2O的質量,然后再根據差量法求出A物質的化學式.
解答 解:操作Ⅰ利用了鋁能溶解在氫氧化鈉溶液的性質,將鋁從廢料中分離出來,過濾后得到含Co2O3•CoO的鈷渣,再用酸溶解過濾后得到含Co3+及Al3+、Li+的濾液,通過調整溶液的pH得到Al(OH)3和LiF沉淀,再過濾得到含Co3+的濾液,再滴加Na2CO3溶液得到CoCO3沉淀,經過濾、洗滌沉淀,最后將CoCO3進行加熱分解可得CoO粉末,
(1)鋁和氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,反應的離子反應方程式為:2Al+2OH-+2H2O=+2AlO2-+3H2↑,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性條件下發生氧化還原反應生成CoSO4、Na2SO4和H2O,反應方程式為:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,由方程式可知氧化劑和還原劑的物質的量之比為4:1,鹽酸具有還原性,能被Co2O3•CoO氧化生成有毒的氯氣而污染環境,所以不能鹽酸,反應的離子方程式為Co2O3•CoO+8H++2Cl-=3Co2++Cl2↑+4H2O(或Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O),
故答案為:4:1;Co2O3•CoO+8H++2Cl-=3Co2++Cl2↑+4H2O(或Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O);
(3)加入氟化鈉,可生成LiF沉淀,鋁離子能與碳酸根離子發生雙水解生成氫氧化鋁和二氧化碳,水解的離子方程式為:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
故答案為:LiF;2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)碳酸鈉溶液在過程Ⅲ中鋁離子能與碳酸根離子發生雙水解生成氫氧化鋁和二氧化碳;碳酸鈉溶液在過程Ⅳ中調整pH,提供CO32-,使Co2+沉淀為CoCO3;
故答案為:調整pH,提供CO32-,使Co2+沉淀為CoCO3;
(5)CoCl2•6H2O~CoCl2
238 130
m 65mg
$\frac{\;\;238\;}{\;m\;}=\frac{130}{\;65mg}$ 解得:m=119mg
A物質的化學式為CoCl2•nH2O,則有:
CoCl2•6H2O~CoCl2•nH2O△m
238 18(6-n)
119mg 119mg-83mg
$\frac{\;\;\;238\;\;}{\;119mg\;}$=$\frac{\;\;18(6-n)}{119mg-83mg}$,解得:n=2,
所以A物質的化學式為:CoCl2•2H2O,
故答案為:CoCl2•2H2O.
點評 本題考查了金屬及其化合物的性質,考查氧化還原反應、離子反應、關系式計算等,難度中等,關鍵根據實驗流程利用氧化還原反應判斷發生的離子反應,是對學生綜合能力的考查,是一道不錯的能力考查題.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水電離的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

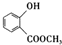 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O. (寫出其中一種的結構簡式).
(寫出其中一種的結構簡式). )是一種重要的有機合成中間體.試寫出以苯、甲苯為原料制取該化合物的合成路線流程圖(無機原料任用).
)是一種重要的有機合成中間體.試寫出以苯、甲苯為原料制取該化合物的合成路線流程圖(無機原料任用).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 犧牲陽極的陰極保護法利用的是原電池原理 | |
| B. | Fe2+能與[Fe(CN)6]3-反應生成帶有特征藍色的沉淀 | |
| C. | 電解質溶液的導電過程一定是電解質溶液的電解過程 | |
| D. | 如果在1.0L Na2CO3溶液中溶解0.010mol的BaSO4,則Na2CO3溶液的最初濃度不得低于0.24 mol/L[已知Ksp(BaSO4)=1.1×10-10; Ksp(BaCO3)=2.6×10-9] |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Na2CO3和HNO3;NaHCO3和HNO3 | B. | BaCl2和Na2CO3;Ba(OH)2和K2CO3 | ||
| C. | Ba(OH)2和NaHSO4;Ba(OH)2和H2SO4 | D. | NaOH和HF;Ba(OH)2和HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HI比HCl穩定 | |
| B. | HI比HCl熔、沸點高 | |
| C. | 溶于水時,HI比HCl更容易電離,所以氫碘酸是強酸 | |
| D. | 拆開等物質的量的HI和HCl,HI消耗的能量多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H=244.1 kJ•mol-1 | B. | △H=-488.3 kJ•mol-1 | ||
| C. | △H=-996.6 kJ•mol-1 | D. | △H=996.6 kJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com