
【題目】依曲替酯是一種皮膚病用藥,它可以由原料X經過多步反應合成。
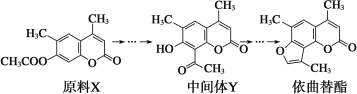
下列說法不正確的是( )
A.原料X與中間體Y互為同分異構體
B.原料X可以使酸性KMnO4溶液褪色
C.中間體Y能發生加成、取代、消去、氧化、還原反應
D.1 mol依曲替酯能與2 mol NaOH發生反應
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是重要漂白劑。某化學興趣小組同學展開對亞氯酸鈉(NaClO2)的研究。
實驗Ⅰ:制取NaClO2晶體
已知:NaClO2飽和溶液在溫度低于38℃時析出的晶體是NaClO23H2O,高于38℃時析出的晶體是NaClO2,高于60℃時NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用下圖所示裝置進行實驗。

(1)裝置②中產生ClO2氣體的化學方程式為 。
(2)從裝置④反應后的溶液獲得晶體NaClO2的操作步驟為:
①減壓,55℃蒸發結晶;②趁熱過濾;③ ;④低于60℃干燥,得到成品。過濾用到的玻璃儀器有 。
(3)設計實驗檢驗所得NaClO2晶體是否含有雜質Na2SO4,操作是: 。
(4)反應結束后,關閉K2、打開K1,裝置①的作用是 ;如果撤去D中的冷水浴,可能導致產品中混有的雜質是 。
實驗Ⅱ:測定某亞氯酸鈉樣品的純度。
設計如下實驗方案,并進行實驗:
①準確稱取所得亞氯酸鈉樣品m g于燒杯中,加入適量蒸餾水和過量的碘化鉀晶體,再滴入適量的稀硫酸,充分反應(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。將所得混合液配成100mL待測溶液。
②移取25.00mL待測溶液于錐形瓶中,用c molL-1 Na2S2O3標準液滴定,至滴定終點。重復2次,測得消耗標準溶液的體積的平均值為V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示劑是 ,達到滴定終點時的現象為 。
(6)樣品中NaClO2的質量分數為 (用含m、c、V的代數式表示,式量:NaClO2 90.5)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學——選修2化學與技術】硫酸工業在國民經濟中占有極其重要的地位。
(1)工業制硫酸時所用硫鐵礦的主要成分為FeS2,其中硫元素的化合物為 。
(2)硫酸的最大消費渠道是化肥工業,用硫酸制造的常見化肥有 (任寫一種)。
(3)硫酸生產中,根據化學平衡原理來確定的條件或措施有 (填寫序號)。
A.礦石加入沸騰爐之前先粉碎 B.使用V2O5作催化劑
C.轉化器中使用適宜的溫度 D.凈化后的爐氣中要有過量的空氣
E.催化氧化在常壓下進行 F.吸收塔中用98.3%的濃硫酸吸收SO3
(4)在硫酸工業中,通過下列反應使二氧化硫轉化為三氧化硫:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在實際工業生產中,常采用“二轉二吸法”,即將第一次轉化生成的SO2分離后,將未轉化的SO2進行二次轉化,假若兩次SO2的轉化率均為95%,則最終SO2的轉化率為 。
(5)硫酸的工業制法過程涉及三個主要的化學反應及相應的設備(沸騰爐、轉化器、吸收塔))。
①三個設備分別使反應物之間或冷熱氣體間進行了“對流”。請簡單描述吸收塔中反應物之間是怎樣對流的。
____________________________________________________________________。
②工業生產中常用氨—酸法進行尾氣脫硫,以達到消除污染、廢物利用的目的。用化學方程式表示其反應原理。(只寫出2個方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)實驗室可利用硫酸廠爐渣(主要成分為鐵的氧化物及少量FeS、SiO2等)制備聚鐵和綠礬(FeSO47H2O),聚鐵的化學式為[Fe2(OH)n(SO4)3﹣0.5n]m,制備過程如圖所示,下列說法正確的是 。

A.爐渣中FeS與硫酸和氧氣的反應的離子方程式為:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.氣體M的成分是SO2,通入雙氧水得到硫酸,可循環使用
C.向溶液X中加入過量鐵粉,充分反應后過濾得到溶液Y,再將溶液Y蒸發結晶即可得到綠礬
D.溶液Z的pH影響聚鐵中鐵的質量分數,若其pH偏小,將導致聚鐵中鐵的質量分數偏大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品。下圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過。
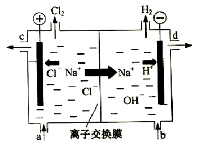
完成下列填空:
(1)寫出電解飽和食鹽水的離子方程式。
(2)離子交換膜的作用為: 、
。
(3)精制飽和食鹽水從圖中 位置補充,氫氧化鈉溶液從圖中 位置流出。(選填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反應生成高效的消毒殺菌劑ClO2,還生成CO2和KHSO4等物質。寫出該反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質]太陽能電池板材料除單晶硅外,還有銅、銦、鎵、硒等化學物質。
(1)基態硅原子的價電子排布圖: 。
(2)硒和硫同為VIA族元素,與其相鄰的元素有砷和溴,則三種元素的第二電離能由小到大的順序為 。(用I2X表示)
(3)氣態SeO3分子的雜化類型為 ,與SeO3互為等電子體的一種陰離子為 (填化學式)。
(4)膽礬CuSO4·5H2O可寫成[Cu(H2O) 4]SO4 ·H2O,其結構示意圖如下:
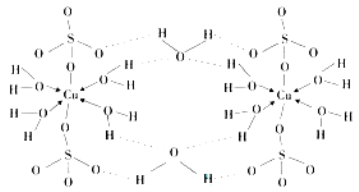
膽礬中含有的粒子間作用力是 (填序號)。
A.離子鍵 B.極性鍵 C.金屬鍵 D.配位鍵 E.氫鍵 F.非極性鍵
(5)在硫酸銅溶液中加入過量KCN,生成配合物K 2[Cu(CN)4],該配合物屬于 晶體,已知CN-與N2為等電子體,指出1molCN-中![]() 鍵的數目為 。
鍵的數目為 。
(6)一種銅金合金晶體具有面心立方最密堆積結構,在晶胞中金原子位于頂點,銅原子位于面心,則該合金中銅原子(Cu)與金原子(Au)個數比為 ;若該晶體的晶胞棱長為a nm,則該合金密度為 g/cm3。(列出計算式,不要求計算結果,阿伏加德羅常數的值為NA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知3.6g碳在6.4g氧氣中燃燒,至反應物耗盡,并放出X kJ熱量。已知1mol單質碳完全燃燒放出熱量為Y kJ,則1molC與O2反應生成CO的熱量變化為
A.放出Y kJ B.放出(5X-5Y) kJ
C.放出(10X-Y) kJ D.吸收(10X-Y) kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,科學家合成了一系列具有獨特化學特性的氫鋁化合物(AlH3)n,常用作還原劑。已知最簡單的氫鋁化合物的化學式為Al2H6,它的熔點為150℃且熔融狀態不能導電,燃燒時放出大量的熱量。Al2H6的球棍模型如圖所示。下列說法錯誤的是
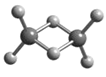
A. Al2H6中Al為-3價,H為+1價
B. Al2H6中含有離子鍵和極性共價鍵
C. Al2H6在固態時所形成的晶體是分子晶體
D. Al2H6在空氣中完全燃燒,產物為氧化鋁和水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2L容器中X.、Y、Z三種物質的物質的量隨時間變化曲線如右圖所示,由圖中數據分析,
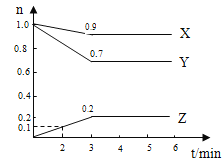
(1)該反應的化學方程式為
(2)反應開始至2min、Z的平均反應速率為 。
(3)平衡時X的體積分數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修3:物質結構與性質】含氮化合物在生活中應用十分廣泛。神州飛船外殼使用了氮化硅新型陶瓷結構材料,該材料硬度大、耐磨損。可用石英與焦炭在1400~1450℃的氮氣氣氛下合成氮化硅,同時生成一種與氮氣結構相似的氣態分子。
(1)寫出上述反應的化學方程式____________________________________。反應原料中涉及的元素電負性由大到小的排列順序為________________________________。
(2)基態氮原子中的原子軌道形狀有 _______________種。
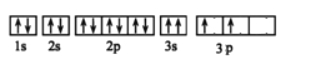
(3)某同學畫出了硅原子基態的核外電子排布圖如下圖,該電子排布違背了 原理。
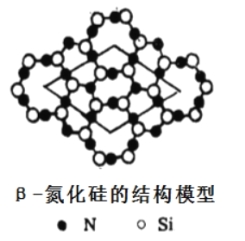
(4)氮化硅有多種型體,其中β-氮化硅層狀結構模型如圖,以圖中所示的平行四邊形為基本重復單元無限伸展,則該基本單元中含氮原子______個,硅原子______個。
(5)含氮的有機化合物氨基乙酸H2NCH2COOH中的碳 原子雜化方式有____________,σ與π鍵的個數比為_______________。
(6)氨分子是一種常見的配體。Cu2+離子在水溶液中以 [Cu (H2O)4]2+形式存在,向含Cu 2+離子的溶液中加入足量氨水,可生成更穩定的[Cu(NH3)4]2+離子,其原因是 。某配合物的化學式為 CoCl3·4NH3, 內界為正八面體構型配離子。0.1 mol該化合物溶于水中,加入過量 AgNO3,有14.35g 白色沉淀生成。則它的中心離子價電子排布式為____________,內界可能的結構有__________種。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com