
【題目】水合草酸亞鐵(FeC2O4·xH2O)在制藥工業上有廣泛應用。以莫爾鹽[(NH4)2SO4·FeSO4·6H2O]為原料制備FeC2O4·xH2O,并探究其性質。回答下列問題:
已知:草酸亞鐵晶體為淡黃色粉末,難溶于水,溶于稀酸;pH>4時,Fe2+容易被氧化。
I.制備FeC2O4·xH2O(如圖)
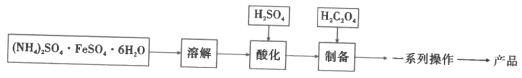
(1)加入H2SO4的目的是__。
(2)制備步驟的離子方程式是__。
(3)一系列操作是__。
II.探究FeC2O4·xH2O的分解產物:CO2、CO(如圖)
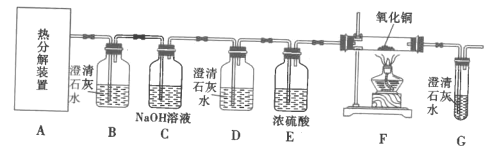
(4)裝置D的作用是__,證明分解產物中存在CO的現象是__。
(5)從綠色化學角度考慮,實驗存在不足之處,指出并提出解決方案:__。
III.定量測定FeC2O4·xH2O的化學式[M(FeC2O4)=144]
操作步驟:準確稱取mg草酸亞鐵晶體,溶于V1mL、c1mol·L-1的H2SO4溶液中,加熱,用KMnO4標準溶液滴定至終點,加入鋅粉將Fe3+恰好全部還原為Fe2+,然后用c2mol·L-1KMnO4標準溶液滴定至終點,記錄消耗KMnO4標準溶液的體積為V2mL。
(6)第二次使用KMnO4標準溶液滴定的離子方程式為__。
(7)x=_(用字母表示)。
【答案】降低pH,防止Fe2+被氧化和水解 Fe2++H2C2O4+xH2O=FeC2O4·xH2O+2H+ 過濾,洗滌,干燥 檢驗CO2是否已除盡 F中生成紅色固體,G中澄清石灰水變渾濁 有毒的CO尾氣未處理,G后接酒精燈點燃或吸收CO的尾氣處理裝置 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O ![]()
【解析】
Ⅰ.莫爾鹽[(NH4)2SO4·FeSO4·6H2O]溶于水后溶液中存在NH4+、Fe2+、SO42-離子,Fe2+離子易水解且易被氧化,加入H2SO4酸化可以防止Fe2+離子被氧化和水解,與H2C2O4反應制得FeC2O4·xH2O;
Ⅱ.檢驗CO2、CO的混合物,需要先用B裝置檢驗CO2的存在,用C裝置中的NaOH溶液除去混合氣體中的CO2,用D裝置檢驗CO2是否除盡,防止對后續實驗造成干擾,E裝置干燥氣體,通過F和G裝置的實驗現象檢驗CO的存在;
Ⅲ.第一次加入高錳酸鉀后,將Fe2+和C2O42-氧化成Fe3+和CO2,加入鋅粉還原Fe3+后,第二次加入高錳酸鉀僅氧化Fe2+。
Ⅰ.莫爾鹽[(NH4)2SO4·FeSO4·6H2O]溶于水后溶液中存在NH4+、Fe2+、SO42-離子,Fe2+離子易水解且易被氧化,加入H2SO4酸化可以防止Fe2+離子被氧化和水解,與H2C2O4反應制得FeC2O4·xH2O;
(1)根據題目信息可得,加入H2SO4的目的是降低pH,防止Fe2+被氧化和水解;
(2)制備步驟的離子方程式是Fe2++H2C2O4+xH2O=FeC2O4·xH2O+2H+;
(3)一系列的操作是將FeC2O4·xH2O分離提純的過程,由于難溶于水,則需要過濾,洗滌,干燥得到產品;
Ⅱ.檢驗CO2、CO的混合物,需要先用B裝置檢驗CO2的存在,用C裝置中的NaOH溶液除去混合氣體中的CO2,用D裝置檢驗CO2是否除盡,防止對后續實驗造成干擾,E裝置干燥氣體,通過F和G裝置的實驗現象檢驗CO的存在;
(4)裝置D的作用是檢驗CO2是否已除盡,若存在CO,CO與F中氧化銅反應生成單質銅和CO2,G中澄清石灰水變渾濁;
(5)CO有毒,該實驗沒有尾氣處理裝置,應該在G后用酒精燈點燃或接吸收CO的尾氣處理裝置;
Ⅲ.第一次加入高錳酸鉀后,將Fe2+和C2O42-氧化成Fe3+和CO2,加入鋅粉還原Fe3+后,第二次加入高錳酸鉀僅氧化Fe2+;
(6)第二次使用KMnO4標準溶液滴定的離子方程式為5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
(7)由化學方程式中各物質的物質的量關系可得:

![]() =
=![]()
解得x=![]() 。
。


 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案科目:高中化學 來源: 題型:
【題目】鐵元素是最重要的金屬元素之一,其不僅是各種鋼材的主要成分,很多含鐵化合物也具有重要意義。
(1)按照電子排布,可把元素周期表中的元素劃分成五個區,鐵元素屬于_________區。
(2)Mn2+在水溶液中難被氧化,而Fe2+則易被氧化為Fe3+ ,請從離子的價電子式角度解釋Mn2+與Fe2+還原能力的差別:_________。Mn2+的半徑_________ Fe3+的半徑(填“>”、“<”或“=”)。
(3)金屬鐵晶體中鐵原子采用體心立方堆積,該鐵晶體的空間利用率為_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成紅色的[Fe(SCN)(H2O)5]2+。N、H、O三種元素的電負性由大到小的順序為_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位數為_________,H2O中氧原子的雜化方式為_________。
(5)二茂鐵是一種含鐵的有機化合物,其化學式為Fe(C5H5)2,可看作是Fe2+離子與兩個正五邊形的環戊二烯負離子(C5H![]() )配體形成的夾心型分子(如下圖a所示)。已知大π鍵可用符號Π
)配體形成的夾心型分子(如下圖a所示)。已知大π鍵可用符號Π![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為Π),則C5H
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為Π),則C5H![]() 的大π鍵表示為________。二茂鐵是黃色針狀晶體,熔點173 ℃(在100 ℃時開始升華),沸點249 ℃,在水中難溶,但可溶于很多有機溶劑。下列相互作用中,二茂鐵晶體中不存在的是________(填標號)。
的大π鍵表示為________。二茂鐵是黃色針狀晶體,熔點173 ℃(在100 ℃時開始升華),沸點249 ℃,在水中難溶,但可溶于很多有機溶劑。下列相互作用中,二茂鐵晶體中不存在的是________(填標號)。
A 離子鍵 B 配位鍵 C σ 鍵 D 范德華力
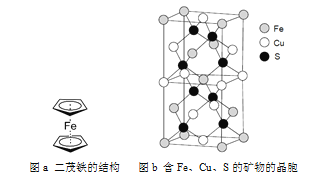
(6)一種含有Fe、Cu、S三種元素的礦物的晶胞(如上圖b所示),屬于四方晶系(晶胞底面為正方形),晶胞中S原子位于內部,Fe原子位于體心和晶胞表面,Cu原子位于晶胞表面。此礦物的化學式為_________。若晶胞的底面邊長為A pm,高為C pm,阿伏伽德羅常數為NA,則該晶體的密度為__________ g/cm3(寫出表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列反應的熱化學方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
則反應4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H為
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為研究用AgNO3溶液將混合溶液中的Cl-和CrO42-沉淀分離,繪制了25℃時AgCl和Ag2CrO4兩種難溶化合物的溶解平衡曲線。其中,pAg+= -lgc(Ag+),其余離子類推。兩條相交的溶解平衡曲線把圖像分成了X、Y、Z、M四個區域。下列說法錯誤的是( )

A.Ksp(Ag2CrO4)約為1 ×10-12,Ksp(AgCl)的數量級為10-10
B.M區域內可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均為0.1 mol/ L的混合溶液中逐滴加入稀硝酸銀溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固體和水的溶解平衡體系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以粉煤灰(主要含Al2O3、SiO2,還有少量的Fe2O3)為原料制取Al2O3的流程如下:
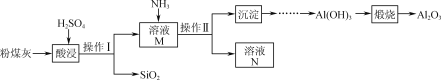
(1)操作Ⅰ的名稱是________;溶液N中的溶質主要是____________(填化學式)。
(2)用H2SO4“酸浸”時的離子方程式為__________________________________(任寫一個)。
(3)“煅燒”時的化學方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,分別向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3,固體(忽略體積變化),如圖為加入Na2CO3的物質的量與-1gc(Mg2+)或-lgc(Mn2+)之間的關系,已知常溫下Ksp(MgCO3)>Ksp(MnCO3),下列說法正確的是( )
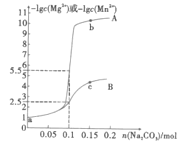
A.曲線A是n(Na2CO3)與-lgc(Mg2+)的關系曲線
B.Ksp(MnCO3)和Ksp(MgCO3)相差3個數量級
C.若將b點和c點溶液混合,存在![]() =1×106
=1×106
D.a點(MgCl2溶液)中存在:c(Mg2+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以菱鎂礦(主要成分是碳酸鎂,含少量FeCO3和不溶性雜質)為原料制取硫酸鎂晶體(MgSO4·7H2O)的流程如圖:
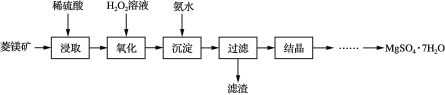
(1)“浸取”時通常將菱鎂礦石進行粉碎,其目的是___。
(2)寫出碳酸鎂與稀硫酸反應的化學方程式___。
(3)“氧化”和“沉淀”是將“浸取”過程中產生的Fe2+轉化為Fe(OH)3沉淀,則“過濾”所得濾液中含有的陽離子主要有___和___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學的核心是發生化學反應,利用化學反應合成物質,同時也伴隨有能量的變化,下列有關說法中不正確的是( )
A.只要發生化學反應就一定有能量變化
B.Zn+2HCl=ZnCl2+H2↑這是一個放熱反應,結論:1molZn和2molHCl的能量之和高于1molZnCl2和1molH2的能量之和
C.反應A+B=C+D的能量變化如圖所示,反應物A和B斷裂化學鍵吸收總能量低于形成生成物C和D釋放的總能量

D.發生化學反應實現了化學能和其他形式能量之間的相互轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究水體中碘的存在形態及其轉化是近年的科研熱點。I-與I2在水體和大氣中的部分轉化如下圖所示。
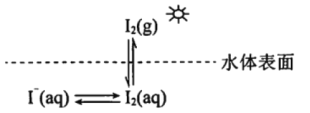
(1) I2的電子式為______________。
(2)水體中的I-在非酸性條件下難于被空氣中的![]() 氧化。原因是
氧化。原因是![]() 的反應速率慢,反應程度小。
的反應速率慢,反應程度小。
①I-在酸性條件下與![]() 反應的離子方程式是_____________________________________。
反應的離子方程式是_____________________________________。
②在酸性條件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有資料顯示:水體中若含有![]() ,會對
,會對![]() 氧化I-產生影響。為檢驗這一結論,進行如下探究實驗:分別將等量的
氧化I-產生影響。為檢驗這一結論,進行如下探究實驗:分別將等量的![]() 通入到
通入到![]() 下列試劑中,一段時間后,記錄實驗現象與結果。己知:每
下列試劑中,一段時間后,記錄實驗現象與結果。己知:每![]() 參與反應,生成
參與反應,生成![]() 。
。
序號 | 試劑組成 | 反應前溶液的 | 反應后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 約10% | |
乙 |
| 5.1 | 4.1 | 約100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反應為可逆反應,其離子方程式是________________________。
③比較甲、乙、丙實驗,說明![]() 在實驗乙中的作用并解釋_______________________。
在實驗乙中的作用并解釋_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com