
【題目】在標準狀況下四種氣體:
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(1)質量由大到小的順序為____________。
(2)氣體密度由大到小的順序為____________。
【答案】![]()
![]()
【解析】
(1)A. ![]() 的物質的量=11.2L÷22.4L/mol=0.5mol ,質量為0.5mol×71 g/mol =35.5g ;
的物質的量=11.2L÷22.4L/mol=0.5mol ,質量為0.5mol×71 g/mol =35.5g ;
B. ![]() 的質量為0.25mol×36.5 g/mol =9.125g ;
的質量為0.25mol×36.5 g/mol =9.125g ;
C. ![]() 的質量是4.4g;
的質量是4.4g;
D. ![]() 的質量是5.1g;
的質量是5.1g;
因此,質量由大到小的順序為![]()
答案為:![]()
(2)據PV=nRT,則P![]() =
=![]() RT,變形可得PM=ρRT,可知在標注狀況下氣體的密度與摩爾質量成正比,A. 氯氣的摩爾質量為71g/mol; B. 氯化氫的摩爾質量為36.5g/mol; C. 一氧化二氮的摩爾質量為44g/mol;D. 氨氣的摩爾質量為17g/mol。
RT,變形可得PM=ρRT,可知在標注狀況下氣體的密度與摩爾質量成正比,A. 氯氣的摩爾質量為71g/mol; B. 氯化氫的摩爾質量為36.5g/mol; C. 一氧化二氮的摩爾質量為44g/mol;D. 氨氣的摩爾質量為17g/mol。
則氣體密度由大到小的順序為![]() 。
。
答案為:![]() 。
。


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案 一線名師權威作業本系列答案
一線名師權威作業本系列答案科目:高中化學 來源: 題型:
【題目】氮及其化合物的轉化過程如下圖所示。

下列分析合理的是( )
A. N2與H2反應生成NH3的原子利用率為100%
B. 催化劑a、b能提高反應的平衡轉化率
C. 催化劑a表面發生了極性共價鍵的斷裂和形成
D. 在催化劑b表面形成氮氧鍵時,不涉及電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤及工業廢氣中的SO2是形成酸雨的主要原因,消除SO2是減少酸雨形成的有效方法。完成下列問題:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
則2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)堿性NaClO2溶液脫硫法
SO2與堿性NaClO2溶液反應的離子方程式為2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在剛性容器中,將含SO2的廢氣通入堿性NaClO2溶液中,測得pc與溫度的關系如圖所示。
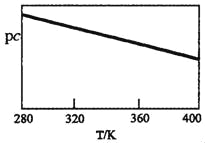
由圖分析可知,該脫硫反應是_____反應(填“放熱”或“吸熱”);若溫度不變,增大壓強,該脫硫反應的平衡常數K_____(填“增大”、“減小”或“不變”)。
(3)燃料細菌脫硫法
①含FeS2的燃煤可用氧化亞鐵硫桿菌(T.f)、氧化亞鐵微螺菌(L.f)、氧化硫硫桿菌(T.t)進行脫硫,其脫硫過程如圖所示:
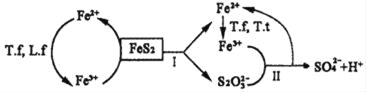
已知:脫硫總反應為:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反應的化學方程式為:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
寫出Ⅱ反應的化學方程式_____。
②在上述脫硫反應中,氧化亞鐵硫桿菌(T.f)與Fe3+的形成過程可視為下圖所示的原電池:

該細胞膜為_____(填“陽離子交換膜”或“陰離子交換膜”)。該電池的正極電極反應式為_____。該方法在高溫下脫硫效率大大降低,原因是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組研究在其他條件不變時,改變密閉容器中某一條件對A2(g)+3B2(g)![]() 2AB3(g) 化學平衡狀態的影響,得到如下圖所示的曲線(圖中T表示溫度,n表示物質的量)。下列判斷正確的是( )
2AB3(g) 化學平衡狀態的影響,得到如下圖所示的曲線(圖中T表示溫度,n表示物質的量)。下列判斷正確的是( )

A. 在T2和n(A2)不變時達到平衡,AB3的物質的量大小 為:c>b>a
B. 若T2>T1,則正反應一定是放熱反應
C. 達到平衡時A2的轉化率大小為:b>a>c
D. 若T2>T1,達到平衡時b、d點的反應速率為vd>vb
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是
A.碳酸鈉溶液與石灰乳反應:CO32-+Ca2+=CaCO3↓
B.向碳酸氫鈣溶液中加入過量氫氧化鈉:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+2H2O+CO32
C.碳酸鋇加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑
D.向沸水中滴加FeCl3飽和溶液制備Fe(OH)3膠體:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稀氨水中存在著下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反應方向移動,同時使c(OH-)增大,應加入的物質或采取的措施是
NH4++OH-,若要使平衡向逆反應方向移動,同時使c(OH-)增大,應加入的物質或采取的措施是
①NH4Cl固體;②硫酸;③NaOH固體;④水;⑤加熱;⑥加入少量MgSO4固體。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇、氧氣和強堿溶液作電解質的手機電池中的反應為2CH3OH+3O2+40H-![]() 2CO32-+6H2O,有關說法正確的是
2CO32-+6H2O,有關說法正確的是
A. 放電時,CH3OH 參與反應的電極為正極
B. 放電時,負極電極反應:CH3OH+8OH--6e-=CO32-+6H2O
C. 標準狀況下,通入的11.2LO2完全反應有1mol電子轉移
D. 充電時電解質溶液的pH逐漸減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物Z是合成平喘藥沙丁胺醇的中間體,可通過下列路線制得:

下列說法正確的是
A. 1 mol Z最多能與2 mol NaOH反應
B. Y可以發生取代反應、氧化反應、消去反應
C. 可用FeCl3溶液鑒別Y和Z
D. X分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種從銅電解工藝的陽極泥中提取Se和Te的流程如下:
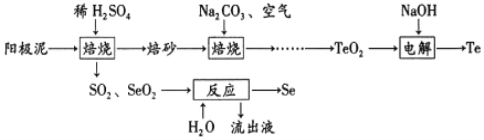
下列敘述錯誤的是( )
A. 合理處理陽極泥有利于保護環境和資源再利用
B. 流出液是H2SO4溶液
C. 電解過程中陰極上析出單質Te
D. “焙砂”與碳酸鈉充分混合后,可在瓷坩鍋中焙燒
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com