
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
分析 由元素在周期表中位置,可知①為C、②為N、③為O、④為F、⑤為Na、⑥為Mg、⑦為Si、⑧為S、⑨為Cl、⑩為Ar.
(1)稀有氣體原子最外層為穩定結構,化學性質最不活潑;
(2)碳在氧氣中燃燒生成二氧化碳;
(3)同周期自左而右原子半徑減小;
(4)氯氣與氫氧化鈣反應生成氯化鈣、次氯酸鈣與水;
(5)主族元素原子最外層電子數等于族序數;
(6)元素⑦的氧化物為二氧化硅,常用于制造光導纖維;
(7)同周期自左而右金屬性減弱,非金屬性越強,氫化物越穩定;
(8)元素②的氫化物為氨氣,元素⑨的最高價氧化物的水化物為高氯酸;
(9)氫氧化鈉與鹽酸反應生成氯化鈉與水.
解答 解:由元素在周期表中位置,可知①為C、②為N、③為O、④為F、⑤為Na、⑥為Mg、⑦為Si、⑧為S、⑨為Cl、⑩為Ar.
(1)稀有氣體Ar的原子最外層為穩定結構,化學性質最不活潑,故答案為:氬;
(2)碳在氧氣中燃燒生成CO2,故答案為:CO2;
(3)同周期自左而右原子半徑減小,第三周期主族元素中Cl原子半徑最小,故答案為:Cl;
(4)氯氣與氫氧化鈣反應生成氯化鈣、次氯酸鈣與水,反應方程式為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)元素④處于第VIIA族,原子最外層電子數為7,故答案為:7;
(6)元素⑦的氧化物為二氧化硅,常用于制造光導纖維,故答案為:光導纖維;
(7)同周期自左而右金屬性減弱,則非金屬性S<cl,故S的活潑性較弱,非金屬性越強,氫化物越穩定,故HCl更穩定,故答案為:S;HCl;
(8)元素②的氫化物為NH3,元素⑨的最高價氧化物的水化物為HClO4,故答案為:NH3;HClO4;
(9)氫氧化鈉與鹽酸反應生成氯化鈉與水,反應方程式為:NaOH+HCl=NaCl+H2O,故答案為:NaOH+HCl=NaCl+H2O.
點評 本題考查元素周期表與元素周期律,難度不大,注意整體把握元素周期表的結構,理解掌握元素周期律.


科目:高中化學 來源: 題型:選擇題
| A. | 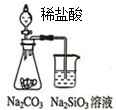 如圖可能證明非金屬性強弱:Cl>C>Si | |
| B. | 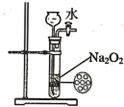 如圖裝置可用來制備少量氧氣,并且控制反應的發生與停止 | |
| C. | 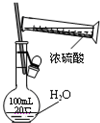 圖中配制一定物質的量濃度的硫酸溶液不能直接在容量瓶中進行 | |
| D. | 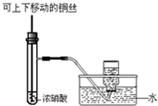 如圖為制備并收集少量NO2氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
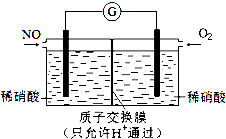 NO和NO2是常見的氮氧化物,研究它們的綜合利用有重要意義.
NO和NO2是常見的氮氧化物,研究它們的綜合利用有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | .甲溶液含有OH- | B. | .乙溶液含有H+ | C. | 丙溶液含有HCO3- | D. | .丁溶液含有NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6.8g液態KHSO4中含有0.1NA個陽離子 | |
| B. | NA個Fe(OH)3膠體粒子形成的納米材料的質量為107g | |
| C. | 等體積等密度的N2和CO所含分子數相同 | |
| D. | 含NA個Na+的Na2O溶解于水1L水中,Na+的物質的量濃度為1mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com