
【題目】砷酸(H3AsO4)是三元弱酸,劇毒,可用于制備顏料、砷酸鹽、殺蟲劑等。常溫下,其溶液中含砷的各微粒的分布分數(平衡時某微粒的濃度占各微粒濃度之和的分數)與pH的關系如圖所示。在常溫下,下列說法錯誤的是
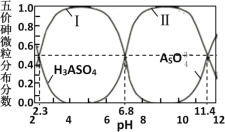
A.曲線Ⅱ代表HAsO![]() 的分布分數
的分布分數
B.該砷酸溶液:Ka2/Ka3=104.6
C.等物質的量濃度的H3AsO4溶液和NaOH溶液等體積混合后所得溶液:pH>7
D.0.1mol/L的Na2HAsO4溶液中: c(HAsO![]() )> c(H2AsO
)> c(H2AsO![]() )> c(AsO
)> c(AsO![]() )
)
【答案】C
【解析】
A.H3AsO4是三元弱酸,在水溶液中分步電離,隨著pH增大電離程度增大;由圖像可知,pH由2增大到5時H3AsO4分布分數降低,以第一步電離為主,曲線Ⅰ代表![]() 的分布分數;pH由5增大到9時
的分布分數;pH由5增大到9時![]() 分布分數降低,以第二步電離為主,曲線Ⅱ代表
分布分數降低,以第二步電離為主,曲線Ⅱ代表![]() 的分布分數,故A正確;
的分布分數,故A正確;
B.由圖像可知,當pH=6.8時,c(![]() )=c(
)=c(![]() ),Ka2=
),Ka2=![]() =10-6.8,當pH=11.4時,c(
=10-6.8,當pH=11.4時,c(![]() )=c(
)=c(![]() ),Ka3=
),Ka3=![]() =10-11.4,則Ka2/Ka3=
=10-11.4,則Ka2/Ka3=![]() =104.6,故B正確;
=104.6,故B正確;
C.等物質的量濃度的H3AsO4溶液和NaOH溶液等體積混合后所得溶液為NaH2AsO4溶液,由圖示可知,當pH=6.8時,c(![]() )=c(
)=c(![]() ),Ka2=
),Ka2=![]() =10-6.8,Kb2=
=10-6.8,Kb2=![]() =10-7.2,則Ka2>Kb2,電離程度大于水解程度,則溶液中pH<7,故C錯誤;
=10-7.2,則Ka2>Kb2,電離程度大于水解程度,則溶液中pH<7,故C錯誤;
D.0.1mol/L的Na2HAsO4溶液中,Ka3=![]() =10-11.4,Kb1=
=10-11.4,Kb1=![]() =10-2.6,則Ka3<Kb1,電離程度小于水解程度,則c(
=10-2.6,則Ka3<Kb1,電離程度小于水解程度,則c(![]() )>c(
)>c(![]() )>c(
)>c(![]() ),故D正確;
),故D正確;
故答案選C。


科目:高中化學 來源: 題型:
【題目】下面三種方法都可以制得Cl2:
①MnO2+4HCl(濃) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(濃)=2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)  2H2O+2Cl2
2H2O+2Cl2
這三種氧化劑的氧化性由強到弱的順序是( )
A.O2>MnO2>KMnO4
B.KMnO4>MnO2>O2
C.MnO2>KMnO4>O2
D.O2>KMnO4>MnO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,我國儲氫碳管研究獲得重大進展,電弧法合成碳納米管,常伴有大量物質——碳納米顆粒,這種碳納米顆粒可用氧化氣化法提純,其反應的化學方程式為:
3C + 2K2Cr2O7 + 8H2SO4(稀)= 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 + 8 H2O
請回答下列問題。
(1)H2O的摩爾質量為___________,0.18g H2O的物質的量為_______________mol
(2)配制0.1mol/L H2SO4溶液500mL,則需要H2SO4的質量為_____________g
(3)在上述的反應中,若生成22g CO2
ⅰ.標準狀況下,CO2的體積為_________L
ⅱ.轉移電子的數目為________________
(4)標準狀況下,由CO和CO2組成的混合氣體為6.72 L,質量為12 g,則該混合氣體的平均相對分子質量是_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有短周期主族元素X、R、Y、Z、T的原子半徑與原子序數的關系如下圖所示。R原子最外層電子數是電子層數的2倍,Y與Z能形成Z2Y、Z2Y2型離子化合物,Z與T形成的簡單離子化合物不能破壞水的電離平衡。下列推斷正確的是

A.氫化物的沸點一定是:Y>R
B.原子半徑和簡單離子半徑均滿足:Z>Y
C.最高價氧化物對應的水化物的酸性:R > T
D.X、R、Y、T四種元素兩兩之間均能形成共價化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列敘述中不正確的是
A.常溫常壓下,71g Cl2含有的氯原子數為2NA
B.1mol Na2O2與H2O完全反應,轉移電子數為NA
C.在標準狀況下,1L H2O所含分子數為![]()
D.1L 0.5mol/L AlCl3溶液中,含有的Cl–數為1.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“治污水”是“五水共治”工程中一項重要舉措。
(1)某污水中的有機污染物為三氯乙烯 (C2HCl3),向此污水中加入一定濃度的酸性重鉻酸鉀(K2Cr2O7還原產物為Cr3+)溶液可將三氯乙烯除去,氧化產物只有CO2。寫出該反應的離子反應方程式_____。
(2)化學需氧量(COD)是水質測定中的重要指標,可以反映水中有機物等還原劑的污染程度。COD是指在一定條件下,用強氧化劑氧化水樣中的還原劑及有機物時所消耗氧化劑的量,然后折算成氧化水樣中的這些還原劑及有機物時需要氧氣的量。某學習小組用重鉻酸鉀法測定某水樣的COD。主要的實驗裝置、儀器及具體操作步驟如下:
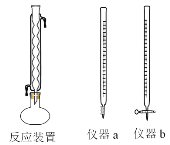
操作步驟:
Ⅰ量取20.00mL水樣于圓底燒瓶中,并加入數粒碎瓷片;Ⅱ量取10.00mL重鉻酸鉀標準溶液中加入到圓底燒瓶中,安裝反應裝置(如上圖所示)。從冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混勻后加熱回流2h,充分反應后停止加熱。Ⅲ待反應液冷卻后加入指示劑2滴,用硫酸亞鐵銨溶液滴定多余重鉻酸鉀,至溶液由綠色變成紅褐色。發生的化學反應方程式為Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O。請回答:
①量取10.00mL重鉻酸鉀標準溶液用到的儀器是_______________(填儀器a或儀器b)。
②下列有關說法正確的是 _________________(用相應編號填寫)。
A. 配制重鉻酸鉀標準溶液時所有需用到儀器有:天平(含砝碼)、玻璃棒、燒杯和容量瓶
B. 滴定前錐形瓶、滴定管均需用蒸餾水洗后再用待取液進行潤洗
C. 滴定時用左手控制旋塞,眼睛注視錐形瓶內液體顏色變化,右手搖動錐形瓶,使溶液向同一方向旋轉
D. 加熱回流結束后,未用蒸餾水沖洗冷凝管管壁,則滴定測得的硫酸亞鐵銨體積偏小
③已知:重鉻酸鉀標準溶液的c(Cr2O72-)=0.02000mol·L-1,硫酸亞鐵銨溶液的c(Fe2+)=0.01000 mol·L-1,滴定終點時所消耗的硫酸亞鐵銨溶液的體積為18.00mL,則按上述實驗方法,測得的該水樣的化學需氧量COD=_______mg/L。
(3)工業上常用鐵炭(鐵屑和活性炭混合物)微電解法處理污水。保持反應時間等條件不變,測得鐵碳混合物中鐵的體積分數、污水溶液pH對污水COD去除率的影響分別如圖1、圖2 所示。
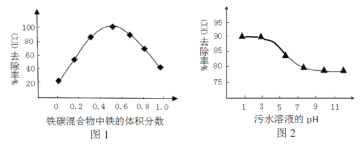
①由圖1、圖2可知下列推論不合理的是________________。
A. 活性炭對污水中的還原性物質具有一定的吸附作用
B. 酸性條件下,鐵屑和活性炭會在溶液中形成微電池,鐵為負極,溶液中有大量的Fe2+、Fe3+
C. 當鐵碳混合物中鐵的體積分數大于50%時,COD的去除率隨著鐵的質量分數增加而下降的主要原因是溶液中微電池數目減少
D. 工業降低污水COD的最佳條件為:鐵的體積分數占50%;污水溶液pH約為3
②根據圖2分析,COD的脫除率降低的原因可能為_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】七水硫酸鎂(MgSO4·7H2O)在印染、造紙和醫藥等工業上有重要的用途。硼鎂泥是硼鎂礦生產硼砂的廢渣,其主要成分是MgCO3,還含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等雜質,工業上用硼鎂泥制取七水硫酸鎂的工藝流程如圖:
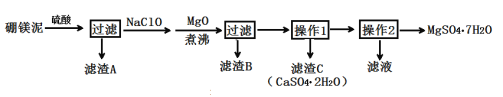
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同溫度下的溶解度(g)數據如下表所示:
溫度/℃ 物質 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)開始用到硫酸的質量分數為70%,密度為1.61g/cm3,則該硫酸溶液的物質的量濃度為___。
(2)濾渣A中除含少量CaSO4·2H2O外,還有___。
(3)加入MgO后,加熱煮沸的目的是___。
(4)若濾渣B的主要成分為Al(OH)3和Fe(OH)3。則加入NaClO發生氧化還原反應的離子方程式為___。
(5)流程中操作1為蒸發濃縮、趁熱過濾,這樣即可得到CaSO4·2H2O,又防止___。
(6)獲取MgSO4·7H2O的操作2為:___、___、過濾洗滌。
(7)已知開始硼鎂泥樣品的質量為ag,制取七水硫酸鎂的質量為bg,據此能計算出硼鎂泥中鎂元素的含量嗎?若能,請寫出表達式;若不能,請說明理由。___(能或不能),表達式(或理由)為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二氯丙烷(CH2ClCHClCH3)是一種重要的化工原料,工業上可用丙烯加成法制備,主要副產物為3-氯丙烯(CH2=CHCH2Cl),反應原理為:
I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
請回答下列問題:
(1)已知CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g)的活化能Ea(正)為132kJ·mol1,則該反應的活化能Ea(逆)為___________kJ·mol1。
CH2ClCHClCH3(g)的活化能Ea(正)為132kJ·mol1,則該反應的活化能Ea(逆)為___________kJ·mol1。
(2)一定溫度下,密閉容器中發生反應I和反應II,達到平衡后增大壓強,CH2ClCHClCH3的產率____________(填“增大”“減小”或“不變”),理由是_____________________________。
(3)起始時向某恒容絕熱容器中充入1mol CH2=CHCH3和1mol Cl2發生反應II,達到平衡時,容器內氣體壓強_________________(填“增大”“減小”或“不變”)。
(4)一定溫度下,向恒容密閉容器中充入等物質的量的CH2=CHCH3(g)和Cl2(g)。在催化劑作用下發生反應I,容器內氣體的壓強隨時間的變化如下表所示。
時間/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
壓強/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用單位時間內氣體分壓的變化來表示反應速率,即![]() ,則前120min內平均反應速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小數點后2位)。
,則前120min內平均反應速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小數點后2位)。
②該溫度下,若平衡時HCl的體積分數為![]() ,則丙烯的平衡總轉化率
,則丙烯的平衡總轉化率![]() ____________;反應I的平衡常數Kp=____________________kPa1(Kp為以分壓表示的平衡常數,保留小數點后2位)。
____________;反應I的平衡常數Kp=____________________kPa1(Kp為以分壓表示的平衡常數,保留小數點后2位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO-+ H+,下列說法正確的是
CH3COO-+ H+,下列說法正確的是
A.向體系中加入少量CH3COONa固體,平衡向左移動,c(CH3COO-)下降
B.向體系中加水稀釋,平衡向右移動,溶液中所有離子的濃度都減小
C.加入少量NaOH固體(忽略溶解熱效應),平衡向右移動,水的電離程度也隨之增大
D.升高體系溫度(忽略醋酸揮發),溶液中H+數目增多,平衡一定向左移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com