
1)一種新型鋰電池是將化學式為Li4Ti5O12的物質作為電池的正極材料,在放電的過程中變為化學式為Li4Ti5O12的物質。
①Li4Ti5O12中Ti元素的化合價為 ,鋰電池的突出優點是 。
②該鋰電池是一種二次電池,放電時的負極反應式為 ,充電時的陽極反應式為 。
(2)用氧化還原滴定法測定制備得到的TiO2試樣中的TiO2的質量分數:在一定條件下,將TiO2溶解并還原為Ti3+,再以KSCN溶液作為指示劑,用NH4Fe(SO4)2標準溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化學方程式為 。
②滴定終點的現象是 。
③滴定分析時,稱取TiO2試樣0.2g,消耗0.1mol·L-1 NH4Fe(SO4)2櫟準溶液20ml.則TiO2的質量分數為____ 。
④若在滴定終點,讀取滴定管刻度時,俯視標準溶液的液面,使其測定結果 (填“偏大”、“偏小”或“無影響”)o
(3)已知: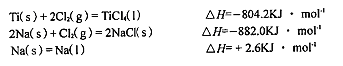
則TiCl4(I)+4Na(l)=Ti(s)+4NaCl(s)的△H= KJ·mol-1。
(1)①+4(1分)體積小、比能量高、攜帶方便。(1分)
②Li-e-=Li+(1分)Li7Ti5O12-3e-=Li4Ti5O12+3Li+(2分)
(2)①TiCl4+(x+2)H2O=TiO2?xH2O↓+4HCl(2分)②溶液變成紅色(1分)
③80%(2分)④偏小(1分)
(3)-970.2(2分)
解析(1)①根據化合物化合價代數和等于零,鋰為+1價,氧為-2價,則鈦為+4價;②放電發生原電池反應,負極Li-e-=Li+;充電發生電解池反應,陽極與外接電源的正極相連失去電子,發生氧化反應,Li7Ti5O12-3e-=Li4Ti5O12+3Li+;
(2)①TiCl4水解生成TiO2?xH2O,根據TiO2的化學式,應有2mol水參與反應,故方程式為TiCl4+(x+2)H2O=TiO2?xH2O↓+4HCl。③n(NH4Fe(SO4)2)=0.1mol/Lⅹ0.02L=0.002mol,此反應是氧化還原反應,根據電子得失守恒,n(NH4Fe(SO4)2)=n(TiO2),m(TiO2)=0.002molⅹ80g·mol-1,0.002ⅹ80/0.2=0.80。④滴定終點,俯視讀數,讀出的數值偏大,則體積差值偏小,故測定結果偏低。(3)根據蓋斯定律,把題中的方程式組合就可得到結果。
TiCl4(l)=Ti(s)+2Cl2(g),ΔH=804.2KJ·mol-
4Na(s)+2Cl2(g)="4NaCl(s)" ΔH=-2ⅹ882.0KJ·mol-
4Na(l)="4Na(s)" ΔH=-4ⅹ2.6KJ·mol-
以上三個相加,就得到△H=-970.2KJ·mol-


科目:高中化學 來源: 題型:填空題
我國是個鋼鐵大國,鋼鐵產量為世界第一,高爐煉鐵是最為普遍的煉鐵方法.
I. 已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+ 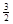 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1 反應:Fe2O3(s)+ 3CO(g)
反應:Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ. 反應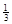 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
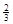 Fe(s)+ CO2(g)在1000℃的平衡常數等于4.在一個容積為10L的密閉容器中,1000℃時加入Fe、Fe2O3、CO、CO2各1.0mol,反應經過l0min后達到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常數等于4.在一個容積為10L的密閉容器中,1000℃時加入Fe、Fe2O3、CO、CO2各1.0mol,反應經過l0min后達到平衡.
(1)CO的平衡轉化率=____________.
(2)欲提高CO的平衡轉化率,促進Fe2O3的轉化,可采取的措施是________.
a.提高反應溫度
b.增大反應體系的壓強
c.選取合適的催化劑
d.及時吸收或移出部分CO2
e.粉碎礦石,使其與平衡混合氣體充分接觸
Ⅲ.高爐煉鐵產生的廢氣中的CO可進行回收,使其在一定條件下和H2反應制備甲醇:
CO(g)+ 2H2(g) CH3OH(g).請根據圖示回答下列問題:
CH3OH(g).請根據圖示回答下列問題: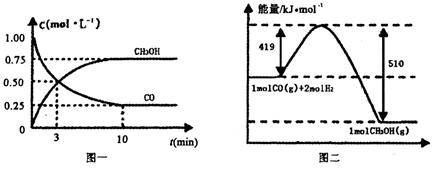
(1)從反應開始到平衡,用H2濃度變化表示平均反應速率v(H2)=________.
(2)若在溫度和容器相同的三個密閉容器中,按不同方式投入反應物,測得反應達到平衡吋的有關數據如下表:
| 容器 | 反應物投入的量 | 反應物的 轉化率 | CH3OH的濃度 | 能量變化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ熱量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ熱量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2013年初,霧霾天氣多次肆虐我國中東部地區。其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。
(l)汽車尾氣凈化的主要原理為: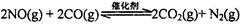 。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如圖所示。據此判斷:
。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如圖所示。據此判斷: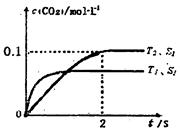
①該反應的ΔH______0(選填“>”、“<”)。
②該反應的平衡常數表達式為____________________
③在T2溫度下,0 ~ 2s內的平均反應速率v(N2)_______。
④當固體催化劑的質量一定時,增大其表面積可提高化學反應速率。若催化劑的表面積S1>S2,在上圖中畫出c(CO2)在T1、S2條件下達到平衡過程中的變化曲線。
⑤該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是__________(填代號)。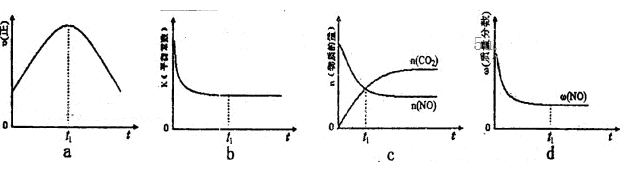
(2)直接排放煤燃燒產生的煙氣會引起嚴重的環境問題。煤燃燒產生的煙氣含氮的氧化物,用CH4催化還原NOx可以消除氮氧化物的污染。例如: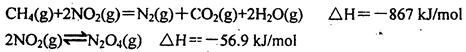
寫出CH4催化還原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的熱化學方程式______
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
目前,消除氮氧化物污染有多種方法。
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
寫出CH4 (g)與NO2 (g)反應生成N2 (g) ,CO2(g)和H2O(l)的熱化學方程 式_____________________
(2)用活性炭還原法處理氮氧化物。有關反應為:C(s)+2NO(g) N2(g)+CO2(g)某研究小組向恒容密閉容器加入一定量的活性炭和NO,恒溫(T。C)條件下反應,反應進行到不同時間測得各物質的濃度如下
N2(g)+CO2(g)某研究小組向恒容密閉容器加入一定量的活性炭和NO,恒溫(T。C)條件下反應,反應進行到不同時間測得各物質的濃度如下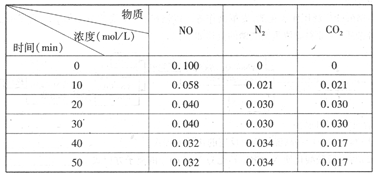
①不能作為判斷反應達到化學平衡狀態的依據 是_______
A.容器內CO2的濃度保持不變
B.v正(N2)="2" v正(NO)
C.容器內壓強保持不變
D.混合氣體的密度保持不變
E.混合氣體的平均相對分子質量保持不變
②在T。C時.該反應的平衡常數為_______(保留兩位小數);
③在30 min,改變某一條件,反應重新達到平衡,則改變的條件是_______
(3)科學家正在研究利用催化技術將超音速飛機尾氣中的NO和CO轉變成CO2和N2,其反應為:
2CO+2NO N2+2CO2 ΔH<0研究表明:在使用等質量催化劑時,增大催化劑的比表面積可提高化學反應速率.為了分別驗證溫度、催化劑的比表面積對化學反 應速率的影響規律、某同學設計了三組實驗,部分實驗條件已經填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等質量催化劑時,增大催化劑的比表面積可提高化學反應速率.為了分別驗證溫度、催化劑的比表面積對化學反 應速率的影響規律、某同學設計了三組實驗,部分實驗條件已經填在下表中。
①上表中:a=_______,b=________,e=________
②請在給出的坐標圖中,畫出上表中實驗II和實驗III條件下混合氣體中NO濃度隨時間變化的趨勢曲線圖,并標明相應的實驗編號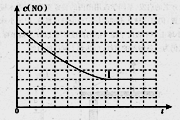
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化學反應變化過程及結果的研究。按要求回答問題:
(1)關于反應過程中能量變化的研究:
則:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)關于反應速率和限度的研究:
工業生產尿素的原理是以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為:
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:
CO(NH2)2 (l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
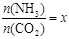 ,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。
,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。

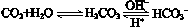 ,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:
,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氮是地球上含量豐富的一種元素,氮元素的單質和化合物在工農業生產、生活中有重要用途。
(1)根據右下能量變化示意圖:
寫出CO和NO2反應生成NO和CO2的熱化學方程式
(2)在固定體積的密閉容器中,進行如下化學反應:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常數K與溫度T的關系如下表,試判斷K1 K2(填“>”、“=”或“<”)
| T /K | 298 | 398 |
| 平衡常數K | K1 | K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
CO2和CH4是兩種重要的溫室氣體,通過CH4和CO2反應制造更高價值化學品是目前的研究目標。
(1)250℃時,以鎳合金為催化劑,向4 L容器中通入6 mol CO2、6 mol CH4,發生如下反應:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡體系中各組分體積分數如下表:
2CO(g)+2H2(g)。平衡體系中各組分體積分數如下表:
| 物質 | CH4 | CO2 | CO | H2 |
| 體積分數 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。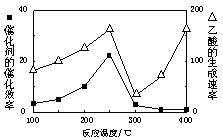
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
直接甲醇燃料電池(DNFC)被認為是21世紀電動汽車最佳候選動力源。
(1)101 kPa時,1 mol CH3OH完全燃燒生成穩定的氧化物放出熱量726.51 kJ/mol,則甲醇燃燒的熱化學方程式為 。
(2)甲醇質子交換膜燃料電池中將甲醇蒸汽轉化為氫氣的兩種反應原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+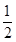 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+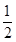 O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
則反應②的△H2= kJ·mol-1。
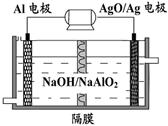
(3)甲醇燃料電池的結構示意圖如右。甲醇進入 極(填“正”或“負”),正極發生的電極反應式為 。負極發生的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
為減小CO2對環境的影響,在限制其排放量的同時,應加強對CO2創新利用的研究。
(1)①把含有較高濃度CO2的空氣通入飽和K2CO3溶液。②在①的吸收液中通高溫水蒸氣得到高濃度的CO2氣體。寫出②中反應的化學方程式__________________________。
(2)如將CO2與H2以1:3的體積比混合。
①適當條件下合成某烴和水,該烴是 (填序號)。
| A.烷烴 | B.烯烴 | C.炔烴 | D.苯的同系物 |
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示。
| 溶解度(S)/g | 溶度積(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com