
(16分)某研究性學習小組為研究鐵粉與濃硫酸反應所生成氣體的成份并測定各氣體的含量,進行了如下實驗:
【實驗推測】足量的鐵粉與濃硫酸反應能生成SO2和H2兩種氣體。
(1)該小組作出此推測的理由是: 。
【實驗準備】a.供選擇的藥品:鐵粉、濃硫酸、氧化銅粉末、0.2 mol/L的H2C2O4標準溶液、0.1 mol/L的酸性KMnO4標準溶液、酸堿指示劑。
b.實驗裝置設計及組裝(加熱及夾持裝置均已略去)
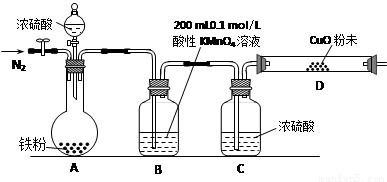
【實驗過程及數據處理】
(2)B中發生反應的離子方程式為: 。
(3)實驗前先通入一段時間的N2,其目的是 。
(4)B、C、D中所盛試劑均足量,則證實生成的氣體中同時存在SO2和H2的現象是
。
(5)A中反應結束后,繼續通N2使A中生成的氣體全部趕出,待B、D中反應完全后,先后三次取用B中反應后的溶液于錐形瓶中,每次取用25 mL,用H2C2O4標準溶液進行滴定。①H2C2O4標準溶液與酸性KMnO4溶液反應的離子方程式如下,請將該方程式完成并配平。
( )H2C2O4+( )MnO4- +( )H+ =( )Mn2+ +( ) H2O+( ) ( )
②滴定達到終點時的現象是 。
③重復滴定兩次,平均每次耗用H2C2O4標準溶液15.63 mL,則鐵與濃硫酸反應產生的SO2氣體的物質的量為 ;經稱量,實驗前后裝置D的質量減少0.8 g,則產生的氣體中SO2的體積分數為 。
(1)在加熱的條件下濃硫酸與Fe反應生成SO2,隨著反應的進行,硫酸濃度變稀,與Fe反應生成H2
(2) 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(3) 排除裝置中的空氣,防止H2與空氣混合受熱發生爆炸。
(4) B瓶中溶液紫紅色變淺說明生成了SO2,D中黑色粉末變紅說明生成了H2。(答對一種得1分) (5) ①5、2、6、2、8、10CO2
②滴入最后一滴H2C2O4溶液時KMnO4溶液的紫紅色褪去且半分鐘之內不恢復。
③0.025 mol, 33.3%
【解析】(1)由于在加熱的條件下濃硫酸與Fe反應生成SO2,隨著反應的進行,硫酸濃度變稀,稀硫酸與Fe反應生成H2。
(2)酸性高錳酸鉀溶液具有氧化性,能氧化SO2,方程式為
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
(3)由于裝置含有空氣,而在加熱條件下,空氣和氫氣混合會發生爆炸,所以應該用氮氣排除
裝置中的空氣。
(4)有SO2,則B瓶中溶液紫紅色變淺說明生成了;含有氫氣,在D中黑色粉末變紅。
(5)①根據氧化還原反應中電子的得失守恒即可配平。氧化劑高錳酸鉀中錳元素的化合價變化是7-2=5,還原劑草酸中碳元素的化合價不敢是2×(4-3)=2,所以氧化劑和還原劑的物質的量之比是2︰5,則反應式為5H2C2O4+2MnO4- +6H+ =2Mn2+ +8 H2O+10CO2.
②由于酸性高錳酸鉀溶液顯紫紅色,所以終點時滴入最后一滴H2C2O4溶液,KMnO4溶液的紫紅色褪去且半分鐘之內不恢復。
③消耗草酸是0.2mol/L×0.01563L=0.003126mol,消耗高錳酸鉀是0.00125mol。所以和SO2反應的高錳酸鉀是0.025L×0.1mol/L-0.00125mol=-0.00125 mol,所以SO2的物質的量是
0.003125mol,所以產生的SO2是0.003125mol×8=0.025mol。根據反應CuO+H2 H2O+Cu可知生成的氫氣是0.8÷16=0.05mol,所以SO2的體積分數是
H2O+Cu可知生成的氫氣是0.8÷16=0.05mol,所以SO2的體積分數是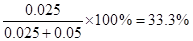


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 有一種褐鐵礦主要成分是Fe2O3,所含雜質不溶于水和酸.某研究性學習小組的同學們利用一小塊樣品,進行了以下實驗.
有一種褐鐵礦主要成分是Fe2O3,所含雜質不溶于水和酸.某研究性學習小組的同學們利用一小塊樣品,進行了以下實驗.查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| 物質 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反應的基本類型為化合反應、分解反應 |
| B、第一、二步反應之間的主要實驗操作是過濾、洗滌 |
| C、第一步反應控制溫度高于30℃目的是提高反應產率 |
| D、反應液加鹽酸處理可使NaCl循環使用并回收NH4Cl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com