
【題目】VmLFe2(SO4)3溶液中含有Fe3+ag,取![]() mL溶液稀釋到5VmL,則稀釋后溶液中SO42﹣的物質的量濃度是
mL溶液稀釋到5VmL,則稀釋后溶液中SO42﹣的物質的量濃度是
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】硫酸鎳是電鍍工業必不可少的化工原料。從不銹鋼廢渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸鎳晶體的工藝流程如下:

已知:①Cr3+與氨水反應時有少量Cr3+生成[Cr(NH3)6]3+,但加熱時該絡合物易分解。Ni2+與氨水反應生成[Ni(NH3)6]2+,該絡合物加熱時穩定,用硫酸酸化時生成相應的硫酸鹽。
②Na2CrO4溶液中加酸調節pH為3.5時,CrO42﹣轉化為Cr2O72﹣。
③相關物質在不同溫度時溶解度如下表:
溫度溶解度/g物質 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化學方程式為_____。“酸浸”時需控制溫度為90℃左右,可以采用的加熱方式是_____。
(2)“過濾”前,適當加熱的目的是_____。
(3)對“過濾”所得的濾渣進行洗滌,檢驗濾渣已洗滌干凈的方法是_____。
(4)“過濾”時產生的濾渣可用于制備Na2Cr2O7晶體。
①濾渣經干燥后與Na2CO3混合在空氣中煅燒生成Na2CrO4和CO2,此反應的化學方程式為_____。
②請補充完整上述煅燒后混合物制備Na2Cr2O7晶體(橙紅色)的實驗方案:水浸,過濾,_____,得Na2Cr2O7晶體(必須使用的試劑有:硫酸,蒸餾水)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制備純硅反應的熱化學方程式:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某溫度、壓強下,將一定量的反應物通入密閉容器中進行以上反應(此條件下為可逆反應),下列敘述正確的是
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某溫度、壓強下,將一定量的反應物通入密閉容器中進行以上反應(此條件下為可逆反應),下列敘述正確的是
A. 反應過程中,若增大壓強能提高SiCl4的轉化率
B. 若反應開始時SiCl4為1 mol,則達到平衡時,吸收熱量為Q kJ
C. 當反應吸收熱量為0.025Q kJ時,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反應
D. 反應至4 min時,若HCl濃度為0.12 mol/L,則H2的反應速率為0.03 mol/( L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨在工農業生產中應用廣泛。在壓強為30 MPa時,合成氨平衡混合氣體中NH3的體積分數如下:
溫度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
請回答:
(1)根據表中數據,結合化學平衡移動原理,說明合成氨反應是放熱反應的原因是__________________________________________________。
(2)根據下圖,合成氨的熱化學方程式是__________________________。
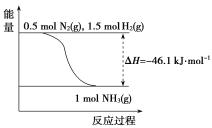
(3)取1 mol N2(g)和3 mol H2(g)放在一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化劑,ΔH________(填“變大”“變小”或“不變”)。
(4)已知:分別破壞1 mol N≡N鍵、1 mol H—H鍵需要吸收的能量為:946 kJ、436 kJ,則破壞1 mol N—H鍵需要吸收的能量為________kJ。
(5)N2H4可視為:NH3分子中的H被—NH2取代的產物。發射衛星用N2H4(g)為燃料,NO2為氧化劑生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
則:1 mol N2H4與NO2完全反應的熱化學方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為1.00 L的容器中,通入一定量的N2O4,發生反應N2O4(g)![]() 2NO2(g),隨溫度升高,混合氣體的顏色變深。回答下列問題:
2NO2(g),隨溫度升高,混合氣體的顏色變深。回答下列問題:
(1)反應的ΔH________0(填“大于”或“小于”);100 ℃時,體系中各物質濃度隨時間變化如圖所示。在0~60 s時段,反應速率v(N2O4)為____________mol·L-1·s-1;反應的平衡常數K1為________。

(2)100 ℃時達平衡后,改變反應溫度為T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,經10 s又達到平衡。
①T________100 ℃(填“大于”或“小于”),判斷理由是______________。
②列式計算溫度T時反應的平衡常數K2________________________。
(3)溫度T時反應達第一次平衡后,將反應容器的容積減少一半,平衡向________(填“正反應”或“逆反應”)方向移動,達到新的平衡后與第一次平衡相對比:顏色____________(填“變深”或“變淺”或“不變”),c(NO2)/c(N2O4)的值_______ (填“增大”、“減小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸溶液中存在電離平衡CH3COOH![]() H++CH3COO-,下列敘述不正確的是
H++CH3COO-,下列敘述不正確的是
A. 升高溫度,平衡正向移動,醋酸的電離常數Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀釋,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固體,平衡逆向移動
D. 室溫下,欲使0.1mol/L醋酸溶液的pH,電離度a都減小,可加入少量水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知短周期主族元素A、B、C、D、E的原子序數依次增加,五種元素中C的原子半徑最大,B與E同主族,D的氧化物既能與酸反應也能與堿反應,E的氧化物是形成酸雨的主要原因,A與E形成的化合物是下水道中具有特殊氣味的氣體。下列說法正確的是
A. 1molA2B2中所含的共用電子對數目為3NA
B. A2E水溶液的電離方程式為A2E![]() 2A++E2-
2A++E2-
C. 最高價氧化物對應的水化物的酸性:D>E
D. 簡單氫化物的熱穩定性:B>E,是因為B的氫化物分子間含有氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室合成溴苯的裝置圖及有關數據如下,按下列合成步驟回答:


(1)實驗裝置中,儀器c的名稱為________________,作用為_______________。
(2)在a中加入15 mL無水苯和少量鐵屑。在b中小心加入4.0 mL液態溴。向a中滴入幾滴溴,有白霧產生,是因為生成了_______氣體。繼續滴加至液溴滴完。寫出a中發生反應的化學方程式:_________________________________________。
(3)液溴滴完后,經過下列步驟分離提純:
①向a中加入10 mL水,然后過濾除去未反應的鐵屑;
②濾液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗滌。NaOH溶液洗滌的作用是____________________________________________;
③向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾。加入無水氯化鈣的目的是_______________。
(4)經以上分離操作后,粗溴苯中還含有的主要雜質為____________,要進一步提純,需進行的操作方法為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在標準狀況下,體積為6.72L的CO質量為___,CO物質的量為____,CO分子數為____,CO摩爾質量為____。
(2)在標準狀況下,體積為8.96 L的CO和CO2的混合氣體共14.4g。CO的質量為____g。CO的體積為___L。混合氣體的平均摩爾質量為___g·mol-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com