
【題目】鋁和鐵是日常生活中用途廣泛的金屬。
(1)常溫下,可用鋁和鐵質容器盛裝濃硫酸的原因是____ 。
(2)但是鋁制容器不能裝NaOH等堿溶液,原因是(用離子方程式表示) ;
(3)工業上冶煉鋁,反應的化學方程式為_
(4)某實驗小組利用右圖裝置驗證鐵與水蒸氣的反應。
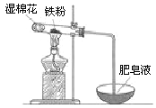
①濕棉花的作用是 ,試管中反應的化學方程式是 _。
②實驗結束后,取出少量反應后的固體于試管中,加入過量鹽酸,固體完全溶解,所得溶液中存在的陽離子是___________(填序號)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
【答案】(1)濃硫酸使鐵、鋁表面形成一層致密穩定的氧化膜(或使鐵、鋁鈍化)
(2)2Al+2OH-+ 2H2O =2AlO2- + 3H2↑
(3)2Al2O3![]() 4Al+ 3O2↑
4Al+ 3O2↑
(4)①提供水蒸氣 3Fe+ 4H2O(g)![]() Fe3O4 + 4H2;② b
Fe3O4 + 4H2;② b
【解析】
試題分析:(1)常溫下,濃硫酸使鐵、鋁表面形成一層致密穩定的氧化膜可用鋁和鐵質容器盛裝濃硫酸,故答案為:濃硫酸使鐵、鋁表面形成一層致密穩定的氧化膜;
(2)鋁能與NaOH溶液反應,2Al+2OH-+ 2H2O =2AlO2- + 3H2↑,鋁制容器不能裝NaOH等堿溶液,故答案為:2Al+2OH-+ 2H2O =2AlO2- + 3H2↑;
(3)工業上用電解熔融的氧化鋁冶煉鋁,反應的化學方程式為2Al2O3![]() 4Al+ 3O2↑,故答案為:2Al2O3
4Al+ 3O2↑,故答案為:2Al2O3![]() 4Al+ 3O2↑;
4Al+ 3O2↑;
(4)①因為是鐵和水蒸氣的反應,試管內有鐵粉,所以濕棉花主要是提供水蒸氣;鐵在高溫下與水反應生成四氧化三鐵和氫氣,反應方程式為:3Fe+4H2O![]() Fe3O4+4H2,故答案為:提供水蒸氣;3Fe+4H2O
Fe3O4+4H2,故答案為:提供水蒸氣;3Fe+4H2O![]() Fe3O4+4H2;
Fe3O4+4H2;
②鐵和水蒸氣反應,產物為四氧化三鐵和氫氣,加入過量鹽酸,固體完全溶解,必發生反應:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,所以所得溶液中存在的陽離子是一定有Fe2+、H+,四氧化三鐵黑色固體中可能含有過量的鐵,可能將三價鐵離子全部轉化成二價鐵離子,Fe+2Fe3+═3Fe2+,所以所得溶液中存在的陽離子是一定有Fe2+、H+,可能有Fe3+,故答案為:b。


科目:高中化學 來源: 題型:
【題目】月球表面土壤里有1種非常有用的資源3He——可控核聚變的原料,有關敘述正確的是( )
A. 在3He中存在:質子數=中子數=核外電子數
B. 3He和4He是同種原子
C. 核聚變時,原子核發生了變化,發生了化學反應
D. 3He和4He互為同位素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定質量含Cu、Cu2O、和CuO的固體混合物,將其分成兩等份并進行下列轉化:
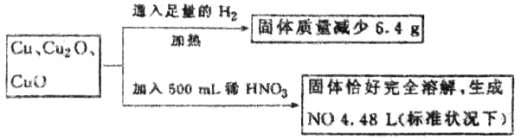
則轉化過程中所加稀HNO3的物質的量濃度為( )
A.3.2mol/L B.3.6mol/L C.4.0mol/L D.4.4mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】咖啡酸苯乙酯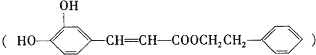 是一種天然抗癌藥物,在一定條件下能發生如下轉化
是一種天然抗癌藥物,在一定條件下能發生如下轉化
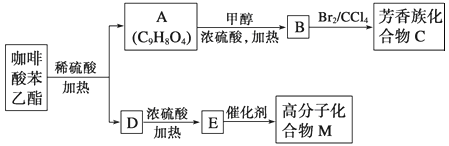
請回答下列問題:
(1)D分子中的官能團是__________;
(2)高分子化合物M的結構簡式是__________;
(3)寫出A→B反應的化學方程式:__________;
(4)B→C的反應類型為__________;
(5)1molA最多可消耗__________molNaOH;
(6)一定條件下1molA最多與__________mol氫氣加成
(7)A的同分異構體有很多種,其中,同時符合下列條件的同分異構體的結構簡式:__________
①苯環上只有兩個取代基 ②能發生銀鏡反應 ③能與碳酸氫鈉溶液反應 ④能與氯化鐵溶液發生顯色反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關。下列有關說法不正確的是( )
A.燃料的脫硫脫氮、NO的催化轉化都是減少酸雨產生的措施
B.利用稀硝酸清除銅鏡表面的銅銹是因為稀硝酸具有強氧化性
C.BaSO4難溶于水和強酸,在醫學上常用作鋇餐
D.食品包裝中常放入有硅膠和鐵粉的小袋,防止食物受潮和氧化變質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用50 mL 0.50 mol·L-1鹽酸、50 mL 0.55 mol·L-1 NaOH溶液和下圖所示裝置進行測定中和熱的實驗,得到表中的數據
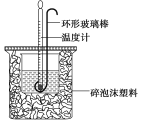
實驗次數 | 起始溫度t1/℃ | 終止溫度t2/℃ | |
鹽酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 24.9 |
(1)碎泡沫塑料的作用是____________________環形玻璃攪拌棒可不可以用銅絲攪拌棒代替,為什么
(2)該實驗測得的中和熱數值為 kJ·mol-1, (鹽酸和NaOH溶液的密度按1 g·cm-3計算,反應后混合溶液的比熱容(c)按4.18 J·(g·℃)-1計算)。
(3)若將NaOH溶液改為相同體積、相同濃度的氨水,測得中和熱的數值 (“偏大”、“偏小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cl2、漂白液(有效成分為NaClO)在生產、生活中廣泛用于殺菌、消毒。
(1)電解NaCl溶液生成氯氣的化學方程式為 。
(2)Cl2溶于H2O、NaOH溶液即獲得氯水、漂白液。
①干燥的氯氣不能漂白物質,但氯水卻有漂白作用,說明起漂白作用的物質是 。
②25℃,Cl2與H2O、NaOH的反應如下:
反應Ⅰ | Cl2+H2O |
反應Ⅱ | Cl2+2OH- |
不直接使用氯水而使用漂白液做消毒劑的原因是 。
(3)家庭使用漂白液時,不宜直接接觸鐵制品,漂白液腐蝕鐵的電極反應為:Fe-2e-=Fe2+;ClO發生的電極反應式是 。
(4)研究漂白液的穩定性對其生產和保存有實際意義.30℃時,pH=11的漂白液中NaClO的質量百分含量隨時間變化如圖所示:
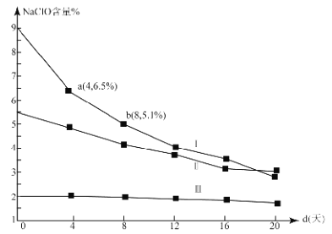
①分解速率v(Ⅰ) v(Ⅱ)(填“>”“<”或“=”),原因是 。
②NaClO分解的化學方程式是 。
③4d-8d,Ⅰ中v(NaClO)= mol/(L·d)(常溫下漂白液的密度約為1g/cm3,且變化忽略不計)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com