
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 無法確定 |
分析 已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+Q1kJ/mol;CuSO4(s)=Cu2+(aq)+SO42-(aq)△H=-Q2kJ/mol;
膽礬溶于水時,溶液溫度降低,反應為CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H′>0;根據蓋斯定律確定△H′與Q1、Q2的關系.
解答 解:已知①CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+Q1kJ/mol;
②CuSO4(s)=Cu2+(aq)+SO42-(aq)△H=-Q2kJ/mol;
③CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H′>0;
根據蓋斯定律:方程③=方程①+方程②,
所以△H′=Q1+(-Q2)>0,即Q1>Q2,
故選A.
點評 本題考查了物質溶解恒容物質分解過程中的能量變化,根據蓋斯定律分析物質溶解過程中的能量變化是解題關鍵,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取適量試劑于潔凈燒杯中,加入足量蒸餾水,充分攪拌,靜置,過濾,得濾液和沉淀. |  |
| 步驟2:取適量濾液于試管中,滴加稀硫酸. | 有白色沉淀生成,說明有Ba2+; |
| 步驟3:取適量步驟1中的沉淀于是試管中,滴加稀鹽酸,用帶塞導氣管塞緊試管,把導氣管插入裝有澄清石灰水的燒杯中 | 試管中有氣泡生成,燒杯中的澄清石灰水變渾濁,結合步驟2說明沉淀是BaCO3 |
| 步驟4:取適量濾液于燒杯中,用pH計測其pH值 | pH>9.6,說明有大量的OH-,綜合上面步驟可知試劑由大量Ba(OH)2•8H2O和少量BaCO3組成,假設成立. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
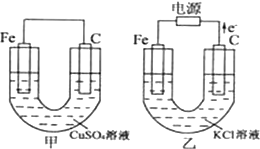 根據如圖所提供的信息,在反應一段時間后:
根據如圖所提供的信息,在反應一段時間后:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 利用如圖裝置測定中和熱的實驗步驟如下:
利用如圖裝置測定中和熱的實驗步驟如下:| 溫度 實驗次數 | 起始溫度t1℃ | 終止溫度t2/℃ | 溫度差平均值 | ||
| HCl | NaOH | 平均值 | (t2-t1)/℃ | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
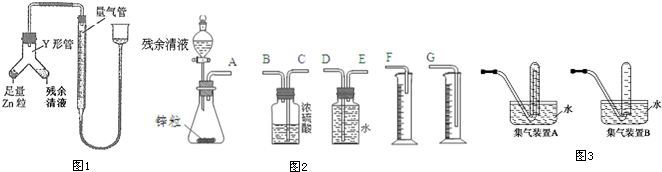
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸的濃度 | B. | 溶液的溫度 | C. | Zn顆粒的大小 | D. | 溶液中Cl-的濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;中間產品C中混有反應物A和B,檢驗C中含有A的試劑是NaHCO3溶液.
;中間產品C中混有反應物A和B,檢驗C中含有A的試劑是NaHCO3溶液. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KHCO3和MgCO3 | B. | MgCO3和NaNO3 | C. | BaCO3和NaHCO3 | D. | Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入AgNO3溶液,有白色沉淀生成,證明有Cl- | |
| B. | 用硝酸酸化后取上層清液,加入Ba(OH)2溶液,析出白色沉淀,證明有SO42- | |
| C. | 加濃NaOH溶液后加熱,產生使濕潤的紅色石蕊試紙變藍色的氣體,證明有NH4+ | |
| D. | 加入鹽酸,放出能使澄清石灰水變渾濁的氣體,證明含有CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com