
如圖裝置,U形管中裝有50 mL 2 mol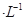 的CuSO4溶液。通電一段時間后,下列說法正確的是
的CuSO4溶液。通電一段時間后,下列說法正確的是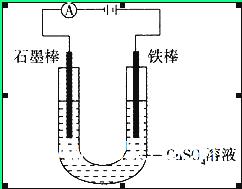
| A.轉移0.2 mol電子時,陽極減少質量大于陰極增加質量 |
| B.轉移0.4 mol電子時,陰極得到2.24 L標準狀況下的氣體 |
| C.電解一段時間后,U形管中會產生紅褐色物質,后來逐漸溶解 |
| D.若將石墨棒換成銅棒,可實現鐵制品上鍍銅 |
B
解析試題分析:該電池中硫酸銅的總的物質的量為0.2mol ,可以電離出0.1mol 的銅離子。在陰陽兩個電極上分別發生的反應為:陽極:Fe-2e-=Fe2+ 陰極:Cu2++2e-=Cu 但是當溶液中的銅離子反應完全之后,就該溶液中由水電離出半的氫離子放電:2H++2e-=H2,因此A、轉移0.2 mol電子時,陽極減少質量為5.6g,小于陰極增加質量6.4g,錯誤;B、轉移0.4 mol電子時,陰極得到2.24 L標準狀況下的氣體-氫氣,正確;C、電解一段時間后,U形管中左端碳棒上會產生紅褐色物質,后來也不溶解,錯誤;D、若將石墨棒換成銅棒,可實現銅的精制,而不是鐵上鍍銅,錯誤。
考點:考查電鍍池的知識。


 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:單選題
鎳氫電池比碳鋅或堿性電池有更大的輸出電流,更適合用于高耗電產品。鎳氫電池的總反應式是 。下列敘述錯誤的是
。下列敘述錯誤的是
| A.電池充電時,氫元素被還原 |
| B.電池放電時,鎳元素被氧化 |
| C.電池放電時,氫氣在負極反應 |
| D.電池放電時,電池負極周圍溶液的堿性減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
固體氧化物燃料電池是由美國西屋(Westinghouse)公司研制開發的.它以固體氧化鋯-氧化釔為電解質,這種固體電解質在高溫下允許氧離子(O2-)在其間通過.該電池的工作原理如圖所示,其中多孔電極a、b均不參與電極反應.下列判斷正確的是 
| A.有O2放電的a極為電池的負極 |
| B.a極對應的電極反應為:O2+ 2H2O+ 4e--= 4OH- |
| C.有H2放電的一極電極反應為:H2+O2- -2 e- =H2O |
| D.該電池的總反應方程式為:2H2+ O2= 2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
關于下列各圖的說法中,正確的是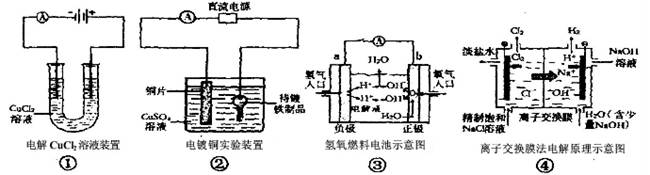
| A.①中與電源負極相連的電極附近能產生使濕潤淀粉KI試紙變藍的氣體 |
| B.②中待鍍鐵制品應該與電源的正極相連接 |
| C.③中的b極是電子流出的極,發生氧化反應 |
| D.④中的離子交換膜可以避免生成的Cl2與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
堿性電池具有容量大、放電電流大的特點,因而得到廣泛應用。鋅-錳堿性電池以氫氧化鉀溶液為電解液,電池總反應式為:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。則下列說法正確的是( )
| A.電池工作時,MnO2發生還原反應 |
| B.電池負極的電極反應式為:2MnO2+H2O+2e-→Mn2O3+2OH- |
| C.電池工作時,K+移向負極 |
| D.電池工作時,電路中每通過0.1mol電子,鋅的質量理論上減少6.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
關于原電池的敘述正確的是( )
| A.構成原電池的正極和負極必須是兩種不同金屬 |
| B.原電池是把化學能轉變為電能的裝置 |
| C.在鉛、銀和鹽酸構成的原電池工作時,鉛板上有5.18 g鉛溶解,正極上就有1 120 mL(標準狀況)氣體析出 |
| D.原電池工作時,正極和負極上發生的都是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
電解質溶液為氫氧化鉀水溶液的氫氧燃料電池電解飽和碳酸鈉溶液一段時間,假設電解時溫度不變且用惰性電極,下列說法正確的是( )
| A.當電池負極消耗mg氣體時,電解池陽極同時有mg氣體生成 |
| B.電池負極反應式為:O2 + 2H2O + 4e—= 4OH— |
| C.電解后c(Na2CO3)不變,且溶液中有晶體析出 |
| D.電池中c(KOH)不變;電解池中溶液pH變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
近年來,加“碘”食鹽較多的使用了碘酸鉀(KIO3),碘酸鉀在工業上可用電解法制取。以石墨和不銹鋼為電極,以KI溶液為電解液,在一定條件下電解,反應方程式為:KI + 3H2O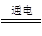 KIO3 + 3H2↑。下列有關說法正確的是
KIO3 + 3H2↑。下列有關說法正確的是
| A.電解時,石墨作陰極,不銹鋼作陽極 |
| B.電解時,陽極反應是:I –-6e–+ 3H2O = IO3 – + 6H+ |
| C.在KI溶液溶液中加入酚酞,電解時陽極區變紅色 |
| D.電解時溶液中I –向陰極遷移 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com