
【題目】元素周期表是指導我們系統學習化學的重要工具。(答案都填寫化學式)
(1)如圖是鐵元素在元素周期表中的有關信息。

寫出Fe的原子結構示意圖__,自然界中存在的54Fe和56Fe,它們互稱為___。將鐵片放入冷濃硫酸中,片刻后將鐵片移入硫酸銅溶液中,發現鐵片表面無明顯變化,原因是__。通常證明某溶液中含Fe2+的化學方法是___。
下表是元素周期表的一部分:
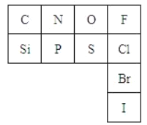
(2)從原子結構角度分析,C、N、O、F四種元素處于同一行,是由于它們的__相同。處于同一列的N和P位于元素周期表的__族。
(3)通過元素周期表,我們可以知道:
①氮元素的最低化合價為_,其氣態氫化物的結構式為__。
②與硅元素處于同一周期,兩性金屬元素是__,并寫出其在元素周期表中的位置:第__周期,__族,該元素的最高價氧化物對應水化物的電離方程式為__。
③第三周期半徑最大的金屬元素__,該元素形成氫氧化物的電子式_,檢驗物質中是否含有該元素的方法是:__。
④在上表所列元素的最高價氧化物對應水化物中酸性最強的是__(寫化學式)。該元素與硫元素相比,非金屬性較強的元素是__(填元素符號),請寫出證明該結論的一個實驗事實:__。
⑤如圖,將潮濕的Cl2單質通過甲裝置后,再通過放有干燥紅色布條的乙裝置,紅色布條不褪色。則甲裝置中所盛試劑可能是___。
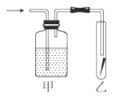
a.濃硫酸 b.NaOH溶液 c.KI溶液 d.飽和食鹽水
⑥由于氫元素的化合價,有人提議還可以將其放在第__族,又有人提議可將它放在周期表中第IVA族,這樣建議的原因是__。
⑦科學家通過對某些元素的化合價進行研究,尋找高效農藥。這些元素往往位于元素周期表的__(選填序號)。
a.左下角區域 b.右上角區域 c.左上角區域 d.右下角區域
【答案】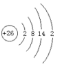 同位素 鐵片在濃硫酸中發生鈍化,表面覆蓋有一層致密的氧化膜,阻止其與硫酸銅溶液發生反應 取樣,向其中滴加KSCN溶液,無明顯變化,滴加氯水,溶液變成血紅色,則含Fe2+ 核外電子層數 VA -3
同位素 鐵片在濃硫酸中發生鈍化,表面覆蓋有一層致密的氧化膜,阻止其與硫酸銅溶液發生反應 取樣,向其中滴加KSCN溶液,無明顯變化,滴加氯水,溶液變成血紅色,則含Fe2+ 核外電子層數 VA -3 ![]() Al 三 IIIA H++AlO2-+H2O
Al 三 IIIA H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH- Na
Al3++3OH- Na ![]() 焰色反應呈黃色 HClO4 Cl 氯氣通入硫化鈉溶液中產生淡黃色沉淀 abc VIIA 其最高正價與最低負價的絕對值相等 b
焰色反應呈黃色 HClO4 Cl 氯氣通入硫化鈉溶液中產生淡黃色沉淀 abc VIIA 其最高正價與最低負價的絕對值相等 b
【解析】
(1)常溫下,Fe和濃硫酸發生鈍化現象;亞鐵離子和KSCN溶液不反應,鐵離子和KSCN溶液反應生成絡合物而使溶液呈血紅色;
(1)Fe的核電荷數為26,原子核外共有26個電子,其原子結構示意圖為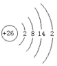 ;自然界中存在的54Fe和56Fe,它們的質子數相同,中子數不等,互稱為同位素;常溫下,Fe和濃硫酸反應生成一層致密的氧化物薄膜而阻止進一步反應,所以鐵片表面無變化,該現象為鈍化;亞鐵離子和KSCN溶液不反應,鐵離子和KSCN溶液反應生成絡合物而使溶液呈血紅色,所以亞鐵離子的檢驗方法為:取樣滴加 KSCN 溶液,溶液無明顯變化,再滴加氯水,出現血紅色,證明含 Fe2+;
;自然界中存在的54Fe和56Fe,它們的質子數相同,中子數不等,互稱為同位素;常溫下,Fe和濃硫酸反應生成一層致密的氧化物薄膜而阻止進一步反應,所以鐵片表面無變化,該現象為鈍化;亞鐵離子和KSCN溶液不反應,鐵離子和KSCN溶液反應生成絡合物而使溶液呈血紅色,所以亞鐵離子的檢驗方法為:取樣滴加 KSCN 溶液,溶液無明顯變化,再滴加氯水,出現血紅色,證明含 Fe2+;
(2)從原子結構角度分析,C、N、O、F四種元素處于同一行,是由于它們的電子層相同.N和P處于同一列,因為它們的最外層電子數相同,它們都位于元素周期表的第VA族;
(3)①氮元素的最低化合價為+5,最低價為-3價,其氣態氫化物的結構式為![]() ;
;
②硅元素處于元素周期表的第三周期,同周期的兩性金屬元素是Al元素,其在元素周期表中的位置是第三周期,IIIA族,該元素的最高價氧化物對應水化物Al(OH)3的電離方程式為H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-;
Al3++3OH-;
③同周期的主族元素,隨核電荷數的增大,原子半徑依次減小,則第三周期半徑最大的金屬元素Na元素,該元素形成氫氧化鈉的電子式為![]() ,利用焰色反應檢驗物質中是否含有該元素,鈉元素焰色反應呈黃色;
,利用焰色反應檢驗物質中是否含有該元素,鈉元素焰色反應呈黃色;
④元素的非金屬性越強,其最高價氧化物水化物的酸性越強,在上表所列元素除F、O無正價外,Cl元素的非金屬性最強,則最高價氧化物對應水化物中酸性最強的是HClO4;將氯氣通入硫化鈉溶液中產生淡黃色沉淀,說明Cl2的氧化性比S強,即氯元素的非金屬性比硫元素強;
⑤最終紅色布條不褪色,說明甲裝置內盛放的液體應與氯氣發生反應或可以干燥氯氣,NaOH溶液、KI溶液能與氯氣反應,濃硫酸干燥氯氣,飽和氯化鈉溶液不能完全吸收氯氣,故答案為abc;
⑥由于氫元素可形成NaH,氫元素顯-1價,則有人提議可將氫元素放在VIIA族;根據最高正價與最低負價的絕對值相等,又可將氫元素放在周期表中的ⅣA族;
⑦科學家通過對某些元素的化合價進行研究,發現通常制造的農藥含有F、Cl、S、P等元素,這些元素位于元素周期表的右上角區域,故答案為b。


科目:高中化學 來源: 題型:
【題目】按要求填空:
(1)有相同溫度和壓強下的兩種氣體12C18O和14N2,若兩種氣體的質量相同,則兩種氣體所含的質子數之比為__________,若兩種氣體的原子數相等,則兩種氣體所含中子數之比_________,若兩種氣體的體積相同,則兩種氣體的密度之比為_________。
(2)10.8 g R2O5中氧原子的數目為3.01×1023,則元素R的相對原子質量為 ________。
(3)將10 mL1.00 mol/L Na2CO3溶液與10 mL1.00 mol/L CaCl2溶液相混和,則混和溶液中Na+的物質的量濃度為___________(忽略混合前后溶液體積的變化)。
(4)在標準狀況下,由CO和CO2組成的混合氣體為6.72 L,質量為12 g,此混合物中CO和CO2物質的量之比是_________。
(5)在空氣中煅燒CoC2O4生成鈷的氧化物和CO2,測得充分煅燒后固體質量為2.41g,CO2的體積為1.344L(標準狀況),則鈷氧化物的化學式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式的書寫正確的是( )
A. H2SO4溶液與Ba(OH)2溶液反應:Ba2++OH﹣+H++![]() →BaSO4↓+H2O
→BaSO4↓+H2O
B. 將Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO﹣+CO2↑+H2O
D. 將Cl2通入水中:Cl2+H2O===2H++Cl﹣+ClO﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《環境科學》刊發了我國科研部門采用零價鐵活化過硫酸鈉(Na2S2O8,其中S為+6價)去除廢水中的正五價砷[As(V)]的研究成果,其反應機制模型如圖所示(SO![]() 、OH表示自由基)。設阿伏加德羅常數的值為NA。下列敘述錯誤的是( )
、OH表示自由基)。設阿伏加德羅常數的值為NA。下列敘述錯誤的是( )

A.過硫酸鈉中-2價氧與-1價氧的個數比為3:1
B.若56gFe參加反應,共有1.5NA個S2O82被還原
C.堿性條件下硫酸根自由基發生反應的方程式為SO4-+OH-=SO42-+OH
D.pH越小,越有利于去除廢水中的正五價砷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對可逆反應4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列敘述正確的是
4NO(g)+6H2O(g),下列敘述正確的是
A.達到化學平衡時,4v正(O2)=5v逆(NO)
B.若單位時間內生成n mol NO的同時,消耗n mol NH3,則反應達到平衡狀態
C.達到化學平衡時,若增加容器體積,則正反應速率減小,逆反應速率增大
D.化學反應速率關系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定量的鐵、氧化亞鐵和氧化鐵的混合粉末中,加入100ml2mol/L的鹽酸,恰好使混合物完全溶解,并放出448ml的氣體(SPT),在所得溶液中加入KSCN溶液無血紅色出現.若用相同質量的上述混合物粉末高溫下同足量的一氧化碳反應,可得到鐵的質量是( )
A.無法計算B.2.8gC.5.6gD.11.2g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面是某科研小組利用廢鐵屑還原浸出軟錳礦(主要成分為MnO2)制備硫酸錳及電解其溶液制錳的工藝流程圖:
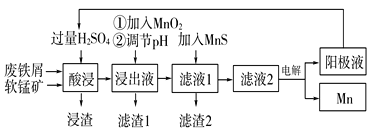
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等雜質金屬離子;
②生成氫氧化物的pH見下表:
物質 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
開始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
請回答下列問題:
(1)“酸浸”前將原料粉碎的目的是____。
(2)流程圖中“①加入MnO2”的作用____,MnO2還可以用其他試劑____(填化學式)代替。
(3)流程圖中“②調節pH”可以除去某種金屬離子,應將溶液pH調節控制的范圍是___~7.6。上述流程中,能循環使用的一種物質是___(填化學式)。
(4)向濾液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等離子,其中可以發生反應為MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。當該反應完全后,濾液2中的Mn2+與Ni2+的物質的量濃度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在適當條件下,在MnSO4、H2SO4和H2O為體系的電解液中電解也可獲得MnO2,其陽極電極反應式為____。
(6)層狀鎳鈷錳三元材料可作為鋰離子電池正極材料,其化學式為LiNixCoyMnzO2,其中Ni、Co、Mn的化合價分別為+2、+3、+4。當x=y=![]() 時,z=___。
時,z=___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是目前大氣中含量最高的一種溫室氣體,中國政府承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~50%。CO2的綜合利用是解決溫室問題的有效途徑。
(1)研究表明CO2和H2在催化劑存在下可發生反應生成CH3OH。己知部分反應的熱化學方程式如下:
CH3OH(g)+ 3/2O2(g) =CO2(g)+2H2O(1) ΔH1=a kJ·mol1
H2(g)+1/2O2(g) =H2O(1) ΔH2=b kJ·mol1
H2O(g) = H2O(l) ΔH3=c kJ·mol1
則 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
(2)為研究CO2與CO之間的轉化,讓一定量的CO2與足量碳在體積可變的密閉容器中反應:C(s)+CO2(g) ![]() 2CO(g) ΔH,反應達平衡后,測得壓強、溫度對CO的體積分數(φ(CO)%)的影響如圖所示。
2CO(g) ΔH,反應達平衡后,測得壓強、溫度對CO的體積分數(φ(CO)%)的影響如圖所示。
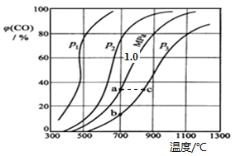
回答下列問題:
①壓強p1、p2、p3的大小關系是______;Ka 、 Kb 、 Kc 為a、b、c三點對應的平衡常數,則其大小關系是______。
②900℃、1.0 MPa時,足量碳與a molCO2反應達平衡后,CO2的轉化率為________ (保留三位有效數字),該反應的平衡常數Kp=______(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
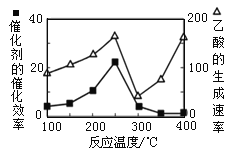
(3)以二氧化鈦表面覆蓋Cu2Al2O4 為催化劑,可以將CO2 和CH4 直接轉化成乙酸,CO2(g)+CH4(g) ![]() CH3COOH(g)。在不同溫度下催化劑的催化效率與乙酸的生成速率如圖所示。250~300 ℃時,乙酸的生成速率降低的主要原因是_______。
CH3COOH(g)。在不同溫度下催化劑的催化效率與乙酸的生成速率如圖所示。250~300 ℃時,乙酸的生成速率降低的主要原因是_______。
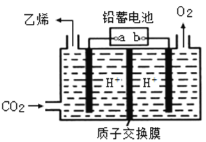
(4)以鉛蓄電池為電源可將CO2轉化為乙烯,其原理如圖所示,電解所用電極材料均為惰性電極。陰極上的電極反應式為__________;每生成0.5mol乙烯,理論上需消耗鉛蓄電池中_____mol硫酸。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列裝置驗證SO2的某些性質(加熱及夾持裝置略去)。
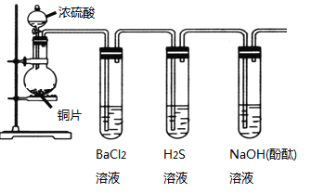
(1)裝有濃硫酸的儀器名稱是____________。
(2)銅與濃硫酸反應的化學方程式是____________________________________。
(3)能驗證SO2具有氧化性的實驗現象是_____________________________。
(4)裝有BaCl2溶液的試管中無任何現象,將其分成兩份,分別滴加氨水和氯水,均產生白色沉淀,沉淀的化學式分別是______,_____。
(5)寫出SO2顯示還原性并生成白色沉淀的總的離子方程式____________________________。
(6)能驗證SO2具有酸性氧化物的通性的實驗現象_____。若通入過量的SO2,則其總反應的離子反應方程式是_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com