
【題目】高氯酸鈉可用于制備高氯酸。以精制鹽水等為原料制備高氯酸鈉晶體(NaClO4·H2O)的流程如圖:
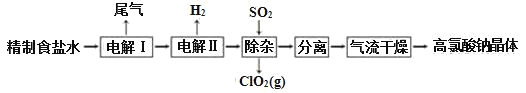
(1)為有效除去Ca2+、Mg2+、SO42-,加入試劑的合理順序為______。
A.先加NaOH,后加Na2CO3,再加鋇試劑
B.先加NaOH,后加鋇試劑,再加Na2CO3
C.先加鋇試劑,后加NaOH,再加Na2CO3
除去鹽水中的Br-可以節省電解過程中的電能,其原因是_____。
(2)“電解Ⅰ”的目的是制備NaClO3溶液,產生的尾氣除H2外,還含有_____(填化學式)。“電解Ⅱ”的化學方程式為____。
(3)“除雜”的目的是除去少量的未反應的NaClO3雜質,該反應的離子方程式為_____。“氣流干燥”時,溫度控制在80~100℃,溫度不能過高的原因是_____。
【答案】BC 電解時Br-被氧化 Cl2 NaClO3+H2O![]() NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 溫度太高,高氯酸鈉晶體失去結晶水或分解
NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 溫度太高,高氯酸鈉晶體失去結晶水或分解
【解析】
由原料氯化鈉到高氯酸鈉晶體,氯的化合價升高,而整個流程中未加強氧化劑,所以通過電解實現了氯的不同價態的轉化(電解過程即為氧化還原反應),將制得的鹽水一次電解產生氯酸鈉,得到的氯酸鈉溶液進行再一次電解,生成高氯酸鈉,然后通入二氧化硫除去其中的氯酸鈉,最后進行分離提純得到高氯酸鈉晶體。
(1)NaOH可以除去Mg2+,鋇試劑可以除去硫酸根,碳酸鈉可以除去鈣離子同時可以除去過量的鋇離子,所以碳酸鈉要在鋇試劑之后加入,所以添加的試劑順序為:先加NaOH,后加鋇試劑,再加Na2CO3或先加鋇試劑,后加NaOH,再加Na2CO3,所以選BC;Br-的還原性強于氯離子,所以電解過程中溴離子優先被氧化,消耗更多的電能;
(2)電解過程中陽極氯離子放電,主要生成氯酸根離子,也有部分產生氯氣,而陰極氫離子放電,生成氫氣,所以尾氣有氫氣和少量的氯氣;電解Ⅱ氯酸根離子在陽極放電生成高氯酸根,而陰極是水電離產生的氫離子放電,生成氫氣,所以電解反應方程式為:NaClO3+H2O![]() NaClO4+H2↑;
NaClO4+H2↑;
(3)由圖示可知通入二氧化硫除去其中的氯酸根離子,Cl(+5→+4),S(+4→+6),根據得失電子守恒和電荷守恒,該反應的離子方程式為:2ClO3-+SO2=2ClO2+SO42-;溫度太高晶體可能失水,同時溫度太高可能使高氯酸鈉分解。


科目:高中化學 來源: 題型:
【題目】已知X、Y、Z都是短周期的元素,它們的原子序數依次遞增,X原子的電子層數與它的核外電子總數相同,而Z原子的最外層電子數是次外層電子數的三倍,Y和Z可以形成兩種以上氣態化合物,則
(1)X的化學式是_____、Y的化學式是_____、Z的名稱是_____。
(2)由Y和Z組成,且Y和Z質量比為7:20的化合物的化學式(分子式)是_____。
(3)由X、Y、Z中的兩種元素組成,且與X2Z分子具有相同電子數的一種陽離子是_____。
(4)由X、Y、Z元素按原子個數比為4:2:3組成的化合物,該化合物的化學式(分子式)是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物丙屬于橋環化合物,是一種醫藥中間體,可以通過以下反應制得:
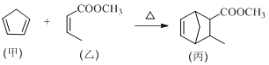
下列有關說法正確的是
A. 甲分子中所有原子可能處于同一平面上
B. 乙可與H2按物質的量之比1∶2發生加成反應
C. 丙能使酸性高錳酸鉀溶液、溴的CCl4溶液褪色,且原理相同
D. 等物質的量的甲、乙分別完全燃燒時,消耗氧氣的質量之比為13∶12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y混合氣體在密閉容器中發生反應:aX(g)+bY(g)![]() cZ(g) ΔH<0;達到化學平衡后,測得X氣體的濃度為0.5 mol/L;恒溫條件下將密閉容器的容積擴大一倍并再次達到平衡時,測得X氣體的濃度為0.3 mol/L。則下列敘述正確的是
cZ(g) ΔH<0;達到化學平衡后,測得X氣體的濃度為0.5 mol/L;恒溫條件下將密閉容器的容積擴大一倍并再次達到平衡時,測得X氣體的濃度為0.3 mol/L。則下列敘述正確的是
A.平衡向右移動 B.a+b>c
C.Y的轉化率提高 D.Z的體積分數增加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用環己醇制備環己酮,使用的氧化劑可以是次氯酸鈉、重鉻酸鉀等。

已知:環己醇沸點:160.8℃,微溶于水;
環己酮沸點:155.6℃,微溶于水;
醋酸沸點117.9℃,和水以任意比例互溶。
下列裝置分別是產品的合成裝置和精制裝置示意圖:
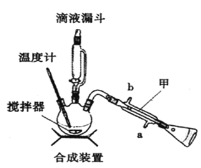
合成實驗過程如下:
向裝有攪拌器、滴液漏斗和溫度計的三頸燒瓶中依次加入5.2mL環己醇和25mL冰醋酸。開動攪拌器,將40mL次氯酸鈉溶液逐漸加入到反應瓶中,并使瓶內溫度維持在30~35℃,用磁性攪拌器攪拌5min。然后,在室溫下繼續攪拌30min后,在合成裝置中再加入30mL水、3g氯化鋁和幾粒沸石,加熱蒸餾至餾出液無油珠滴出為止。回答下列問題:
(1)在合成裝置中,甲裝置的名稱是_____________。
(2)三頸燒瓶的容量為_____________(填“50mL"、“100mL”或“250mL")。
(3)滴液漏斗具有特殊的結構,主要目的是_____________。
(4)蒸餾完成后,向餾出液中分批加入無水碳酸鈉至反應液呈中性為止,其目的是_____________。然后加入精制食鹽使之變成飽和溶液,將混合液倒入_____________中,分離得到有機層。
(5)用如圖對粗產品進行精制,蒸餾收集_____________℃的餾分。
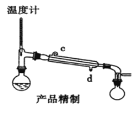
(6)檢驗環己酮是否純凈,可使用的試劑為_____________。
A.重鉻酸鉀溶液B.金屬鈉C.新制的氫氧化銅懸濁液D.醋酸溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分析核電荷數為1 ~ 18的元素原子的核外電子層數和最外層電子數,回答下列問題:
(1)核電荷數為6和14的元素原子,它們的____________相同,____________不相同;核電荷數為15和16的元素原子,它們的____________相同,____________不相同;核電荷數為10和18的元素原子,它們的最外層電子數均為____________,它們的元素符號分別是____________、____________。
(2)某元素的原子核外有三個電子層,最外層電子數是核外電子總數的![]() ,該元素的元素符號是____________,原子結構示意圖是____________。
,該元素的元素符號是____________,原子結構示意圖是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法或表示方法中正確的是( )
A.銅的電解精煉中,若陽極質量減少32g,則轉移電子的電子數為6.02×1023
B.吸熱反應發生過程中要不斷從外界獲得能量,放熱反應一定不需要吸收外界能量
C.在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,則氫氣燃燒的熱化學方程式為:2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol
D.已知稀溶液中:H+(aq)+OH-(aq)=H2O(l)ΔH=-53.7kJ/mol,若將含0.5molH2SO4的濃溶液與含1molNaOH的溶液混合,放出的熱量大于53.7kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下CO2與NH3混合反應,可以合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH,若該反應在一恒溫、恒容密閉容器內進行,判斷反應達到平衡狀態的標志是( )
CO(NH2)2(s)+H2O(g) ΔH,若該反應在一恒溫、恒容密閉容器內進行,判斷反應達到平衡狀態的標志是( )
A.CO2與H2O(g)濃度相等
B.容器中氣體的壓強不再改變
C.2v(NH3)正=v(H2O)逆
D.容器中混合氣體的密度不再改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語正確的是 ( )
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. CaCO3的電離:CaCO3![]() Ca2++CO32-
Ca2++CO32-
C. 碳酸鈣的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. Na2S溶液的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com