
【題目】丙烷脫氫是工業生產丙烯的重要途徑,其熱化學方程式為![]()
![]() ,請回答下列相關問題。
,請回答下列相關問題。
![]() 下表為部分鍵能數據,據此可算出
下表為部分鍵能數據,據此可算出![]() ___________
___________![]() 。
。
化學鍵 |
|
|
|
|
鍵能 | 332 | 611 | 414 | 436 |
![]() 一定溫度下,向
一定溫度下,向![]() 的密閉容器中充入
的密閉容器中充入![]() 發生脫氫反應,經過
發生脫氫反應,經過![]() 達到平衡狀態,測得平衡時氣體壓強是開始的
達到平衡狀態,測得平衡時氣體壓強是開始的![]() 倍。
倍。
![]() 內氫氣的生成速率
內氫氣的生成速率![]() _______,
_______,![]() 的平衡轉化率為_______。
的平衡轉化率為_______。
![]() 下列情況能說明該反應達到平衡狀態的是____________
下列情況能說明該反應達到平衡狀態的是____________![]() 填標號
填標號![]() 。
。
A.混合氣體的平均相對分子質量保持不變 ![]() 與
與![]() 的物質的量之比保持不變
的物質的量之比保持不變
C.混合氣體的密度保持不變 ![]() 的分解速率與
的分解速率與![]() 的消耗速率相等
的消耗速率相等
![]() 脫氫反應分別在壓強為
脫氫反應分別在壓強為![]() 和
和![]() 時發生,丙烷及丙烯的平衡物質的量分數隨溫度變化如圖所示:
時發生,丙烷及丙烯的平衡物質的量分數隨溫度變化如圖所示:
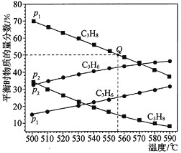
![]() 壓強:
壓強:![]() _________
_________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 為了同時提高反應速率和反應物的平衡轉化率,可采取的措施是___________。
為了同時提高反應速率和反應物的平衡轉化率,可采取的措施是___________。
![]() 若
若![]() ,起始時充入丙烷發生反應,則Q點對應溫度下,反應的平衡常數
,起始時充入丙烷發生反應,則Q點對應溫度下,反應的平衡常數![]() _______
_______![]() 用平衡分壓代替平衡濃度計算,分壓
用平衡分壓代替平衡濃度計算,分壓![]() 總壓
總壓![]() 物質的量分數
物質的量分數![]() 。
。
![]() 實際生產中常在恒溫、恒壓的密閉容器中充入丙烷和氬氣發生脫氧反應,充入氬氣的原因是______________。
實際生產中常在恒溫、恒壓的密閉容器中充入丙烷和氬氣發生脫氧反應,充入氬氣的原因是______________。
【答案】![]()
![]()
![]()
![]()
![]() 升高溫度
升高溫度 ![]() 提高丙烷的平衡轉化率
提高丙烷的平衡轉化率
【解析】
(1)反應熱=反應物總鍵能-生成物總鍵能;
(2)①平衡壓強是起始的1.4倍,因此平衡時氣體總物質的量為2.8mol。增加了0.8mol;

求得v(H2)=![]() ,也得到丙烷平衡轉化率;
,也得到丙烷平衡轉化率;
②結合平衡狀態的特征分析判斷;
(3)①其它條件一定,加壓平衡逆向移動,丙烷的平衡百分含量增大;
②升溫提高反應速率和反應物的平衡轉化率;
③Q點丙烯和氯氣的物質的量之比為1:1,因此物質的量分數均為25%,丙烷、丙烯、氯氣的平衡分壓依次為0.05 MPa、0.25MPa、0.025MPa,求得平衡常數Kp;
④在恒溫、恒壓的密閉容器中,增大氬氣的量,體積增大,相當于減壓,從而使得平衡正向移動,提高了丙烷的平衡轉化率越大。
![]() 反應熱
反應熱![]() 反應物總鍵能
反應物總鍵能![]() 生成物總鍵能
生成物總鍵能![]() ;
;
![]() 平衡壓強是起始的
平衡壓強是起始的![]() 倍,因此平衡時氣體總物質的量為
倍,因此平衡時氣體總物質的量為![]() ,增加了
,增加了![]() ;
;

因此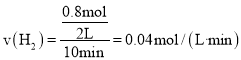 ,丙烷平衡轉化率
,丙烷平衡轉化率![]() ;
;
![]() 氣體平均分子量不變說明氣體總物質的量不變,可以證明體系達平衡狀態,故A正確;
氣體平均分子量不變說明氣體總物質的量不變,可以證明體系達平衡狀態,故A正確;
B.起始只充入了丙烷,![]() 與
與![]() 的物質的量之比始終為1:1,不能證明體系達平衡狀態,故B錯誤;
的物質的量之比始終為1:1,不能證明體系達平衡狀態,故B錯誤;
C.純氣體體系且恒容,氣體密度始終保持不變,不能證明體系是否達平衡狀態,故C錯誤;
D.![]() 的分解速率等于
的分解速率等于![]() 的生成速率,也就是
的生成速率,也就是![]() 的消耗速率與生成速率相等,可以證明體系達平衡狀態,故D正確;
的消耗速率與生成速率相等,可以證明體系達平衡狀態,故D正確;
故答案為:AD;
![]() 其它條件一定,加壓平衡逆向移動,丙烷的平衡百分含量增大,因此
其它條件一定,加壓平衡逆向移動,丙烷的平衡百分含量增大,因此![]() ;
;
![]() 根據
根據![]() 計算結果或者圖像均可知正反應吸熱,升溫能同時提高反應速率和反應物的平衡轉化率;
計算結果或者圖像均可知正反應吸熱,升溫能同時提高反應速率和反應物的平衡轉化率;
![]() 設丙烷物質的量為1mol,消耗物質的量為x,圖象中可知丙烷在Q點物質的量分數為
設丙烷物質的量為1mol,消耗物質的量為x,圖象中可知丙烷在Q點物質的量分數為![]() ;
;
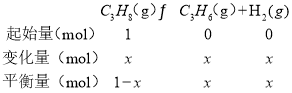
![]() ,
,![]() ,則Q點對應溫度下反應的平衡常數Kp
,則Q點對應溫度下反應的平衡常數Kp ;
;
![]() 該反應的氣體分子數增加的反應,隨著氬氣比例的增加,降低了反應體系各氣體的分壓,相當于減壓,減小壓強平衡向氣體體積增大的方向移動,從而提高丙烷脫氫轉化率。
該反應的氣體分子數增加的反應,隨著氬氣比例的增加,降低了反應體系各氣體的分壓,相當于減壓,減小壓強平衡向氣體體積增大的方向移動,從而提高丙烷脫氫轉化率。


 全程金卷系列答案
全程金卷系列答案科目:高中化學 來源: 題型:
【題目】以葡萄糖為燃料的微生物燃料電池的結構如圖所示。下列關于該電池的敘述不正確的是( )

A.該裝置屬于原電池
B.放電過程中,H+從負極區向正極區遷移
C.在電池反應中,每消耗1 mol氧氣,理論上能生成11.2 L(標準狀況)CO2
D.電池負極的電極反應式為C6H12O6+6H2O-24e-=6CO2↑+24H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在K2Cr2O7溶液中存在下列平衡:2CrO42—(黃色)+2H+![]() Cr2O72—(橙色)+H2O中,溶液顏色介于黃色和橙色之間,今欲使溶液顏色變成黃色,根據勒夏特列原理可以在溶液中加入( )
Cr2O72—(橙色)+H2O中,溶液顏色介于黃色和橙色之間,今欲使溶液顏色變成黃色,根據勒夏特列原理可以在溶液中加入( )
①H+ ②OH- ③K+ ④H2O
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定條件下達到平衡狀態,時間為t1時改變條件.化學反應速率與反應時間的關系如圖所示.下列說法正確的是( )
2SO3(g)△H<0,在一定條件下達到平衡狀態,時間為t1時改變條件.化學反應速率與反應時間的關系如圖所示.下列說法正確的是( )

A. 維持溫度、容積不變,t1時充入SO3(g)
B. 維持壓強不變,t1時升高反應體系溫度
C. 維持溫度、容積不變,t1時充入一定量Ar
D. 維持溫度、壓強不變,t1時充入SO3(g)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】應對霧霾污染、改善空氣質量需要從多方面入手,如開發利用清潔能源.甲醇是一種可再生的清潔能源,具有廣闊的開發和應用前景.回答下列問題:
(1)![]() 與
與![]() 合成甲醇:
合成甲醇:![]() 但是找到合適的催化劑是制約該方法的瓶頸.目前主要使用貴金屬催化劑,但是貴金屬儲量稀少,成本高昂,難以大規模應用,且使用中存在環境污染的風險.最近采用真空封管法制備磷化硼納米顆粒,在發展非金屬催化劑實現
但是找到合適的催化劑是制約該方法的瓶頸.目前主要使用貴金屬催化劑,但是貴金屬儲量稀少,成本高昂,難以大規模應用,且使用中存在環境污染的風險.最近采用真空封管法制備磷化硼納米顆粒,在發展非金屬催化劑實現![]() 電催化還原制備甲醇方向取得重要進展,該反應歷程如圖所示.
電催化還原制備甲醇方向取得重要進展,該反應歷程如圖所示.

容易得到的副產物有CO和![]() ,其中相對較多的副產物為________________;上述合成甲醇的反應速率較慢,要使反應速率加快,主要降低下列變化中________
,其中相對較多的副產物為________________;上述合成甲醇的反應速率較慢,要使反應速率加快,主要降低下列變化中________![]() 填字母
填字母![]() 的能量變化.
的能量變化.
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)恒壓![]() 容器的容積可變
容器的容積可變![]() 下,
下,![]() 與
與![]() 在催化劑作用下發生反應
在催化劑作用下發生反應![]()
![]() ,
,![]() 的平衡轉化率與溫度、壓強的關系如圖所示.
的平衡轉化率與溫度、壓強的關系如圖所示.

①壓強![]() ________
________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
②在![]() 、
、![]() 條件下,b點時
條件下,b點時![]() ________
________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
③已知:反應速率![]() ,
,![]() 、
、![]() 分別為正、逆反應速率常數,x為物質的量分數,若b點對應的坐標參數為
分別為正、逆反應速率常數,x為物質的量分數,若b點對應的坐標參數為![]() ,計算b處的
,計算b處的![]() ________
________![]() 保留3位有效數字
保留3位有效數字![]() .
.
(3)焦炭與水蒸氣在恒容密閉容器中反應制合成氣的主要反應![]() Ⅰ
Ⅰ![]() 、
、![]() Ⅱ
Ⅱ![]() 的
的![]() 為以分壓表示的平衡常數
為以分壓表示的平衡常數![]() 與T的關系如下圖所示.
與T的關系如下圖所示.

①反應![]() Ⅱ
Ⅱ![]() 的
的![]() ________
________![]() 填“大于”“等于”或“小于”
填“大于”“等于”或“小于”![]() .
.
②![]() 點時,反應
點時,反應![]() 的
的![]() ________
________![]() 填數值
填數值![]() .
.
③在恒容密閉容器中充入![]() 、
、![]() 只發生反應
只發生反應![]() Ⅱ
Ⅱ![]() ,圖中d點處達到平衡時,CO的轉化率為________;達到平衡時,向容器中再充入
,圖中d點處達到平衡時,CO的轉化率為________;達到平衡時,向容器中再充入![]() 、
、![]() ,重新達到平衡時,CO的平衡轉化率________
,重新達到平衡時,CO的平衡轉化率________![]() 填“增大”“減小”或“不變”
填“增大”“減小”或“不變”![]() .
.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組用下列裝置進行乙醇催化氧化的實驗。

(1)實驗過程中銅網出現紅色和黑色交替的現象,請寫出相應的化學反應方程式:______________________________________________。
在不斷鼓入空氣的情況下,熄滅酒精燈,反應仍能繼續進行,說明該乙醇氧化反應是________反應。
(2)甲和乙兩個水浴作用不相同。
甲的作用是__________________________;乙的作用是__________________________。
(3)反應進行一段時間后,干燥試管a中能收集到不同的物質,它們是________________。集氣瓶中收集到的氣體的主要成分是__________________________。
(4)若試管a中收集到的液體用紫色石蕊試紙檢驗,試紙顯紅色,說明液體中還含有__________。要除去該物質,可先在混合液中加入________________(填寫字母)。
a.氯化鈉溶液 b.苯
c.碳酸氫鈉溶液 d.四氯化碳
然后,再通過________________(填實驗操作名稱)即可除去。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列溶液中由水電離的氫離子濃度為1×10-5的是 ( )
A.pH=5的HClO 溶液B.pH=9的氨水
C.pH=5的AlCl3溶液D.pH=5的NaHSO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關醛的說法正確的是
A.分子通式為CnH2nO的有機物與乙醛一定互為同系物
B.用溴水可以檢驗CH2=CHCHO中含有的碳碳雙鍵
C.對甲基苯甲醛(![]() )可使酸性KMnO4溶液褪色,說明醛基具有還原性
)可使酸性KMnO4溶液褪色,說明醛基具有還原性
D.能發生銀鏡反應的有機物不一定是醛類
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用化石燃料開采、加工過程產生的H2S 廢氣制取氫氣,既價廉又環保。
(1)工業上可用組成為K2O·M2O3·2RO2·nH2O的無機材料純化制取的氫氣。
①已知元素M、R均位于元素周期表中第3周期,兩種元素原子的質子數之和為27,則R的原子結構示意圖為____________;
②常溫下,不能與M單質發生反應的是____________(填序號);
a.CuSO4溶液 b.Fe2O3 c.濃硫酸 d.NaOH溶液 e.Na2CO3固體
(2)利用H2S廢氣制取氫氣的方法有多種。
①高溫熱分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密閉容器中,控制不同溫度進行H2S分解實驗。以H2S起始濃度均為c mol·L-1測定H2S的轉化率,結果見圖。曲線a為H2S的平衡轉化率與溫度關系曲線,b曲線表示不同溫度下反應經過相同時間且未達到化學平衡時H2S的轉化率。根據圖像回答下列問題:

i 計算 985 ℃時H2S按上述反應分解的平衡常數 K=________;
ii 說明隨溫度的升高,曲線b向曲線a逼近的原因:________________________________;
②電化學法

i該法制氫過程如圖。反應池中反應物的流向采用氣、液逆流方式,其目的是____________;
ii反應池中發生反應的化學方程式為____________;
iii反應后的溶液進入電解池,電解總反應的離子方程式為_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com