(2013?保定一模)[化學-選修物質結構與性質]
納米技術制成的金屬燃料、非金屬固體燃料、氫氣等已應用到社會生活和高科技領域.
單位質量的A和B單質燃燒時均放出大量熱,可用作燃料.已知A和B為短周期元素,其原子的第一至第四電離能如下表所示:
| 電離能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(1)某同學根據上述信息,推斷B的核外電子排布如右圖所示,
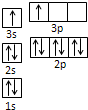
該同學所畫的電子排布圖違背了
能量最低原理
能量最低原理
.
(2)根據價層電子對互斥理論,預測A和氯元素形成的簡單分子空間構型為
直線形
直線形
.
(3)氫氣作為一種清潔能源,必須解決它的儲存問題,C
60可用作儲氫材料.已知金剛石中的C-C的鍵長為154.45pm,C
60中C-C鍵長為145~140pm,有同學據此認為C
60的熔點高于金剛石,你認為是否正確
不正確
不正確
,并闡述理由
C60是分子晶體,熔化時不需破壞化學鍵
C60是分子晶體,熔化時不需破壞化學鍵
.
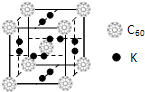
(4)科學家把C
60和鉀摻雜在一起制造了一種富勒烯化合物,其晶胞如圖所示,該物質在低溫時是一種超導體.寫出基態鉀原子的電子排布式
1s22s22p63s23p64s1
1s22s22p63s23p64s1
,該物質的K原子和C
60分子的個數比為
3:1
3:1
.
(5)繼C
60后,科學家又合成了Si
60、N
60,C、Si、N原子電負性由大到小的順序是
N>C>Si
N>C>Si
.Si
60分子中每個硅原子只跟相鄰的3個硅原子形成共價鍵,且每個硅原子最外層都滿足8電子穩定結構,則Si
60分子中π鍵的數目為
30
30
.





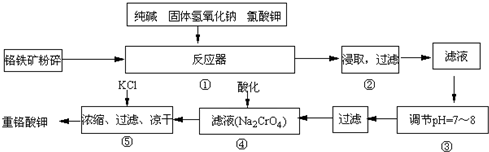
 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O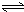 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O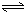 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O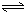 Al(OH)3+OH-),降低pH值有利于平衡向正反應方向移動,當pH調到7~8時,使它們水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反應方向移動,當pH調到7~8時,使它們水解完全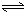 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O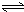 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O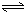 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O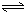 Al(OH)3+OH-),降低pH值有利于平衡向正反應方向移動,當pH調到7~8時,使它們水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反應方向移動,當pH調到7~8時,使它們水解完全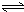 Cr2O72-+H2O
Cr2O72-+H2O Cr2O72-+H2O
Cr2O72-+H2O