
下列有關pH變化判斷中,正確的是
A.隨著溫度的升高,Na2CO3溶液pH減小
B.隨著溫度的升高,純水的pH增大
C.新制氯水經光照一段時間后,溶液pH減小
D.氫氧化鈉溶液久置于空氣中,溶液pH增大
 星級口算天天練系列答案
星級口算天天練系列答案科目:高中化學 來源:2015-2016學年西藏拉薩中學高二上第一次月考化學試卷(解析版) 題型:選擇題
應用元素周期律推斷,下列說法正確的是
A.Sr(鍶)的碳酸鹽難溶于水 B.Tl(鉈)的氫氧化物是兩性氫氧化物
C.H2Se比H2S更穩定 D.H3AsO4酸性比H3PO4強
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三上學期第一次模擬化學試卷(解析版) 題型:選擇題
在100 mL HNO3和H2SO4混合溶液中,兩種酸物質的量濃度之和為0.60 mol/L。向該溶液中加入足量的銅粉,加熱,充分反應后,所得溶液中Cu2+的物質的量濃度最大為
A.0.225 mol/L B.0.36 mol/L C.0.30 mol/L D.0.45 mol/L
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅蘭州一中高二上期中測試文科化學試卷(解析版) 題型:選擇題
在標準狀況下,0.5mol二氧化碳的體積約是
(A)0.5L (B)22.4L (C)11.2L (D)44.8L
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省高三上學期第二次月考理綜化學試卷(解析版) 題型:實驗題
(15分)醫療上綠礬(FeSO4·7H2O)是治療缺鐵性貧血的特效藥。某化學興趣小組對綠礬進行了如下的探究:
Ⅰ.【制備產品】
該小組由廢鐵屑(含少量氧化銅、氧化鐵等雜質),用如圖所示裝置制備FeSO4•7H2O晶體,步驟如下:
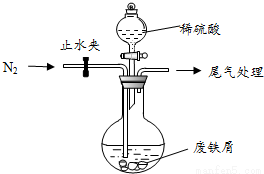
(1)預處理:先將廢鐵屑加入到飽和Na2CO3溶液中洗滌,目的是___________,然后將廢鐵屑用水洗滌2~3遍。
(2)將洗滌后的廢鐵屑加入到圓底燒瓶中,并持續通入N2,N2的作用是_____________。
(3)再加入足量稀硫酸,控制溫度50℃~80℃之間,充分反應后,圓底燒瓶中剩余的固體為_____________。
(4)獲取產品:先向步驟(3)中反應后的混合物中加入少許蒸餾水,趁熱過濾,_________________。濾出晶體,用少量冰水洗滌2~3次,再用濾紙將晶體吸干,密閉保存。
Ⅱ.【測定FeSO4•7H2O含量】
(1)稱取上述樣品10.0g,溶于適量的稀硫酸中,配成100mL溶液,需要的儀器除天平、玻璃棒、燒杯、量筒外,還需要的儀器有(填儀器名稱)___________________、_________________。
(2)準確量取25mL該液體于錐形瓶中,用0.1000mol/L KMnO4標準溶液滴定,則滴定終點的判斷方法是_______________。
(3)用同樣的方法滴定3次,平均消耗10.00mL標準液,該樣品中FeSO4•7H2O的質量分數為_____________。(已知Mr(FeSO4•7H2O)=278)。
(4)若測量結果偏小,則可能是在定容時__________________(填“俯視”或“仰視”)讀數。
查看答案和解析>>
科目:高中化學 來源:2016屆山東省南校區高三上學期10月階段測化學試卷(解析版) 題型:填空題
(12分)反應A(g)+B(g)?C(g)+D(g)過程中的能量變化如圖所示(E1>0,E2>0),回答下列問題。

①圖中E1代表的意義是_____________________。
該反應是______________反應(填“吸熱”或“放熱”)。反應熱ΔH的表達式為________________。
②當反應達到平衡時,升高溫度,A的轉化率______________(填“增大”“減小”或“不變”)。
(2)800 ℃時,在2 L密閉容器內充入0.50 mol NO和0.25 mol O2,發生如下反應:2NO(g)+O2(g)===2NO2(g)ΔH<0。體系中,n(NO)隨時間的變化如下表:
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
①能說明該反應已達到平衡狀態的是______________。
A.v(NO2)正=v(O2)逆 B.容器內壓強保持不變
C.v(NO)逆=2v(O2)正 D.容器內氣體顏色不變
②能使該反應的反應速率增大,且平衡向正反應方向移動的措施是______________。
A.適當升高溫度 B.縮小反應容器的體積
C.增大O2的濃度 D.選擇高效催化劑
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三上10月階段質檢化學試卷(解析版) 題型:填空題
(10分)電浮選凝聚法是工業上采用的一種污水處理方法:保持污水的pH在5.0~6.0之間,通過電解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉積下來,具有凈化水的作用。陰極產生的氣泡把污水中懸浮物帶到水面形成浮渣層,除去浮渣層,即起到了浮選凈化的作用。某科研小組用電浮選凝聚法處理污水,設計裝置示意圖,如圖所示。
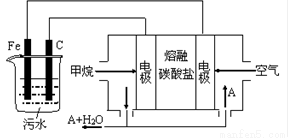
(1)實驗時若污水中離子濃度較小,導電能力較差,產生氣泡速率緩慢,無法使懸浮物形成浮渣。此 時,可向污水中加入適量的 。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)電解池陽極發生了兩個電極反應,其中一個反應生成一種無色氣體,則陽極的電極反應式分別是
①.______________________;②. 。
(3)電極反應①和②的生成物反應得到Fe(OH)3沉淀的離子方程式是____________________。
(4)該燃料電池是以熔融碳酸鹽為電解質,CH4為燃料,空氣為氧化劑,稀土金屬材料作電極。為了使該燃料電池長時間穩定運行,電池的電解質組成應保持穩定,電池工作時必須有部分A物質參加循環(如圖)。A物質的化學式是____________________。
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省常德市高三上學期第三次月考化學試卷(解析版) 題型:選擇題
A、B、C、X均為中學化學常見物質,一定條件下它們有如下轉化關系(部分產物已略去),下列說法錯誤的是

A.若X為Cl2,則C可能為Fe
B.若X為KOH溶液,則A可能為AlCl3溶液
C.若X為O2,則A可能為C
D.若A、B、C均為焰色反應呈黃色的化合物,則X可能為CO2
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二上學期9月月考化學試卷(解析版) 題型:選擇題
熱化學方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示
CO(g)+H2(g);△H =+131.3kJ/mol表示
A.碳和水反應吸收131.3kJ能量
B.1mol碳和1mol水反應生成一氧化碳和氫氣并吸收131.3kJ熱量
C.1mol固態碳和1mol水蒸氣反應生成一氧化碳氣體和氫氣,并吸熱131.3kJ
D.1個固態碳原子和1分子水蒸氣反應吸熱131.1kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com