
把少量金屬鈉投入下列溶液中,寫出有關反應的化學方程式:
(1)鈉投入稀鹽酸中 。
(2)鈉投入硫酸銅溶液中 。
(1)2Na+2HCl=2NaCl+H2↑。
(2)2Na+2H2O=2NaCl+H2↑、 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
解析試題分析:鈉是極活潑的金屬,極易和水反應,生成氫氧化鈉和氫氣。然后生成的氫氧化鈉再和溶液中的溶質反應,據此可知
(1)鈉投入稀鹽酸中反應的方程式是2Na+2HCl=2NaCl+H2↑。
(2)鈉投入硫酸銅溶液中的方程式是2Na+2H2O=2NaCl+H2↑、 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4。
考點:考查鈉與溶液反應方程式的書寫
點評:該題是基礎性試題的考查,也是高考中的常見考點,側重對學生基礎知識的鞏固和訓練,有利于培養學生的邏輯推理能力和規范答題能力。該題的關鍵是明確鈉是極活潑的金屬,溶于水首先與反應,然后在根據溶質判斷即可。


科目:高中化學 來源: 題型:填空題
金屬鉬(Mo)可以增強合金的某些機械性能和耐腐蝕性。下圖是化工生產中制備金屬鋁的實驗流程圖(已知鋁酸為難溶于水和酸的黃色晶體):
(1)在灼燒鋁礦時發生化學反應: ,該反應的還原劑是__________。當有1mol MoS2反應時,還原劑失去電子的物質的量為________。
,該反應的還原劑是__________。當有1mol MoS2反應時,還原劑失去電子的物質的量為________。
(2)步驟①中,灼燒鉬礦時,用于盛放固體的儀器的名稱為________。
(3)寫出步驟②中發生反應的離子方程式_________________________________。
(4)在步驟③中需要加入過量硝酸,檢驗硝酸過量的操作為_________________。
(5)某同學擬選用如下裝置,用氫氣還原三氧化鋁,同時檢驗該反應的氧化產物,根據要求回答下列問題。
①若兩次使用到C裝置,則裝置D中所盛的藥品是________(填試劑名稱)。
②根據完整的實驗裝置進行實驗,實驗步驟如下:檢查裝置氣密性后,裝入藥品;打開分液漏斗活塞后______→______→______→______(請按正確的順序填入下列步驟的代號)。
a.收集氣體并檢驗其純度 b.停止加熱,充分冷卻
c.加熱反應一段時間 d.關閉分液漏斗活塞,停止通氫氣
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某研究性學習小組利用下列原料和流程制備CuSO4·5H2O。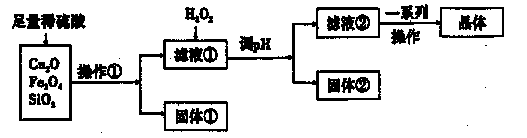
已知:Cu+在酸性條件下不穩定,易生成金屬Cu和Cu2+。
(1)操作①的名稱為____。 ,
(2)若固體①的成分為混合物,則其成分的化學式為____。
(3)將H2O2加入濾液①中,發生反應的離子方程式為 。
(4)調pH可選用的藥品為____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鐵是一種典型的過渡金屬,鐵和鐵的化合物在生產和生活中有廣泛的應用。完成下列計算:
(1)將11.802 g鋼樣粉末(只含鐵和碳)于高溫下置于足量的純氧中充分反應,冷卻后得到16.240 g磁性氧化鐵。
①鋼樣中含鐵________g。
②生成的CO2在標準狀況下體積為________mL。
(2)向10 mL氯化鐵溶液(含鹽酸0.001 mol)中加入16.8 g 5%的燒堿溶液(足量),充分反應后過濾。洗滌沉淀,將洗滌液與濾液合并后稀釋至250mL。取25mL稀釋液,用0.100 mol/L鹽酸滴定,終點時消耗鹽酸的體積15.50mL。計算原溶液中Fe3+的物質的量濃度。
(3)鐵銹的主要成分實為羥基氧化鐵[化學式FeO(OH)]。將一塊帶銹鐵片放入700mL pH=0的稀硝酸中充分反應,收集到標準狀況下NO氣體3.584 L,最終剩余2.020g鐵。求:
①反應后溶液中溶質的成分與物質的量。
②原帶銹鐵片中鐵銹的質量分數。
(4)用FeSO4和NaOH制備Fe(OH)2時,往往會形成一種灰綠色的中間物(用X表示)。經分析,X中含有三種陰離子與兩種陽離子,陰、陽離子的總質量之比為11:12。已知兩種陽離子為Fe2+與Fe3+,物質的量之比為2:1。請通過計算確定X的化學式。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鐵及其化合物有重要用途,如聚合硫酸鐵[Fe2(0H)n(S04)3-n/2]m是一種新型高效的水 處理混凝劑,而高鐵酸鉀(其中鐵的化合價為+6)是一種重要的殺菌消毒劑,某課題小組設 計如下方案制備上述兩種產品:
請回答下列問題:
(1)若A為H20(g),可以得到Fe304,寫出H2O的電子式:_______.
(2)若B為NaC103與稀硫酸,寫出其氧化Fe2+的離子方程式(還原產物為Cl-):____。
(3)若C為KNO3和KOH的混合物,寫出其與Fe2O3加熱共融制得高鐵酸鉀的化學方程式 并配平:
(4)為測定溶液I中鐵元素的總含量,實驗操作:準確量取20.00mL溶液I于帶塞錐形瓶 中,加入足量H2O2,調節pH<3,加熱除去過量H2O2;加入過量KI充分反應后,再用0.1000mol.L-1Na2S2O3標準溶液滴定至終點,消耗標準溶液20.00mL。
已知:
①寫出滴定選用的指示劑______,滴定終點觀察到的現象______:
②溶液丨中軼元素的總含量為______g.L-1。若滴定前溶液中H202沒有除盡,所測定的鐵元 素的含量將會______ (填“偏高” “偏低” “不變”)。
(5)設計實驗方案,檢驗溶液I中的Fe2+和Fe3+______。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14 分)鋁是地殼中含量最高的金屬元素,其單質及合金在生產生活中的應用日趨廣泛。
(1)真空碳熱還原-氯化法可實現由鋁土礦制備金屬鋁,其相關反應的熱化學方程式如下:
Al2O3(s)+AlC13(g)+3C(s) ="3AlCl(g)+3CO(g)" △H="a" kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g) △H="b" kJ·mol-1
①反應Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b 的代數式表示)。
②Al4C3是反應過程中的中間產物。Al4C3與鹽酸反應(產物之一是含氫量最高的烴) 的化學方程式為 。
(2)鎂鋁合金(Mg17Al12 )是一種潛在的貯氫材料,可在氬氣保護下,將一定化學計量比的Mg、Al 單質在一定溫度下熔煉獲得。該合金在一定條件下完全吸氫的反應方程式為Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定條件下可釋放出氫氣。
①熔煉制備鎂鋁合金(Mg17Al12)時通入氬氣的目的是 。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全釋放出H2。1 mol Mg17 Al12完全吸氫后得到的混合物Y 與上述鹽酸完全反應,釋放出H2的物質的量為 。
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 圖8
混合物Y 均只能部分放出氫氣,反應后殘留固體物質的X-射線衍射譜圖如圖所示(X-射線衍射可用于判斷某晶態物質是否存在,不同晶態物質出現衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中產生氫氣的主要物質是 (填化學式)。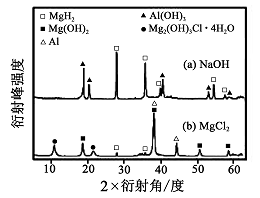
(3)鋁電池性能優越,Al-AgO 電池可用作水下動力電源,其原理如圖所示。該電池反應的化學方程式為 。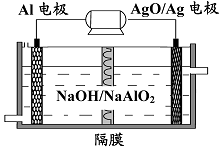
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)某同學探究同周期元素性質遞變規律時,自己設計了一套實驗方案,并記錄了有關實驗現象(見下表,表中的“實驗步驟”與“實驗現象”前后不一定是對應關系)。
| 實驗步驟 | 實驗現象 |
| ①將鎂條用砂紙打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向運動,隨之消失,溶液變成紅色 |
| ②向新制得的Na2S溶液中滴加新制氯水 | B.有氣體產生,溶液變成淺紅色 |
| ③將金屬鈉放入滴有酚酞溶液的冷水中 | C.劇烈反應,迅速產生大量無色氣體 |
| ④將鎂條投入稀鹽酸中 | D.反應較快,產生無色氣體 |
| ⑤將鋁條投入稀鹽酸中 | E. 生成白色膠狀沉淀,繼而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至過量 | F.生成淡黃色沉淀 |
| 實驗步驟 | 實驗現象 | 離子方程式 |
| ① | | (不需填寫) |
| ② | | |
| ③ | | |
| ④ | C | (不需填寫) |
| ⑤ | D | |
| ⑥ | | |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
用含有A12O3、SiO2和少量FeO·xFe2O3的鋁灰制備A12(SO4)3·18H2O。工藝流程如下: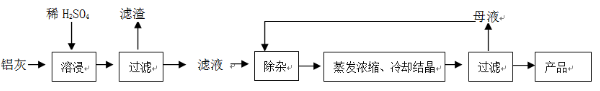
(一定條件下,MnO4- 可與Mn2+反應生成MnO2)
已知: 生成氫氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 開始沉淀時 | 3.4 | 6.3 | 2.7 |
| 完全沉淀時 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(14分)FeSO4·7H2O廣泛用于醫藥和工業領域,以下是FeSO4·7H2O的實驗室制備流程圖。根據題意完成下列填空:
(1)鐵屑與稀硫酸反應前,應用10% Na2CO3溶液浸泡幾分鐘,操作目的是_____,浸泡后,用____(填操作方法)分離并洗滌鐵屑。
(2)操作a為_______________。
(3)最后得到的綠礬晶體用少量冰水洗滌,其目的是:①除去晶體表面附著的硫酸等雜質;
②____________________。
(4) FeSO4·7H2O是某些補血劑的主要成分,實驗室要測定某補血劑中鐵元素的含量。
I.方案一:可用KMn04溶液進行氧化還原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液時,所用的儀器有天平、藥匙、燒杯、玻璃棒,還有___________(填儀器名稱)。在配制過程中,下列說法正確的是____________(填序號字母)。
| A.KMnO4溶于水不放熱,可以直接在容量瓶中溶解 |
| B.容量瓶洗滌后不需干燥即可直接用于實驗 |
| C.定容后搖勻,凹液面低于刻度線,再加水至凹液面最低點與刻度線相平 |
| D.如果定容時加水超過刻度線必須毓配制 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com