
【題目】下列說法符合事實的是
A.強酸與強堿中和滴定時可以選用甲基橙或酚酞作指示劑;強堿與弱酸中和滴定時應該選用酚酞作指示劑
B.在5![]() 的
的![]() 溶液中加入3mL等濃度的NaCl溶液,有白色沉淀產生,再加入3mL等濃度的
溶液中加入3mL等濃度的NaCl溶液,有白色沉淀產生,再加入3mL等濃度的![]() 溶液,溶液中又有黑色沉淀生成,說明
溶液,溶液中又有黑色沉淀生成,說明![]()
C.物質的量濃度均為![]() 的弱酸HX及其鹽NaX溶液等體積混合后:
的弱酸HX及其鹽NaX溶液等體積混合后:![]()
![]()
D.已知![]() ,
,![]() 。在含
。在含![]() 、
、![]() 濃度相同的溶液中滴加
濃度相同的溶液中滴加![]() 溶液時,首先生成
溶液時,首先生成![]() 沉淀
沉淀
 階梯計算系列答案
階梯計算系列答案科目:高中化學 來源: 題型:
【題目】下面四種變化中,有一種變化與其他三種變化類型不同的是( )
A.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B.CH3CH2Br+NaOH ![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr→CH3CH2Br + H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是學習化學的重要工具,它隱含著許多信息和規律。
I.請根據下表中短周期元素的原子半徑和主要化合價,回答表后問題。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半徑(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合價 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置為________。
(2)元素①、⑦的氫化物的穩定性由強到弱的順序為_________(填化學式);
(3)元素①、③形成的18電子化合物的電子式為______;
(4)元素②、⑧的最高價氧化物對應的水化物中,堿性較強的是______(填化學式);
(5)元素⑤、⑧的最高價氧化物對應的水化物的水溶液反應的離子方程式為_________。
II.以下每小題中的電池廣泛使用于日常生活、生產和科學技術等方面,請根據題中提供的信息,填寫空格。
(6)鉛蓄電池在放電時發生的電池反應式為:Pb+PbO2+2H2SO4===2PbSO4+2H2O。鉛蓄電池放電時正極是__(填物質化學式)。若電解液體積為2L(
(7)甲醛(HCHO)燃料電池的工作原理如下圖所示。

①該電池工作時,b口通入的物質為________;
②該電池工作時,電子的流向為___________(填“從左到右”或“從右到左”);
③右側電極的電極反應方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列我國科技創新的產品設備在工作時,能量轉化過程與氧化還原反應有關的是( )
|
|
|
|
①長征三號運載火箭用偏二甲肼為燃料 | ②嫦娥四號月球探測器上的太陽能電池板 | ③和諧號動車以350 km/h飛馳 | ④世界首部可折疊柔屏手機通話 |
A.①②B.③④C.②③D.①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是化學課外活動小組設計的用化學電源(鋅銅硫酸原電池)使LED燈發光的裝置示意圖。下列有關該裝置的說法正確的是( )

A.銅片為負極B.鋅片上發生還原反應
C.其能量轉化的形式主要是“化學能→電能→光能”D.如果將稀硫酸換成鹽酸,LED燈將不會發光
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維生素C的結構簡式如圖所示:

⑴維生素C分子中—OH原子團的名稱是__________________;維生素C__________________溶于水(填“易”或“難”),屬于________________ 維生素(填“脂溶性”或“水溶性”)。
⑵維生素C又被稱為抗壞血酸,它能促進膠原蛋白形成,所以能防治_____________
⑶一個人每天攝入約100mg維生素C就能滿足需要,下列物質中含有豐富維生素C的是____
A.苦瓜 B.雞蛋 C.豆腐 D.沙丁魚
⑷“服用維生素C,可使食物中的三價鐵離子還原成二價鐵離子”這句話說明:維生素C具有_____________性(填“氧化性”或“還原性”);維生素C在這一反應中發生了_____________(填“氧化反應”或“還原反應”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】屬于加成反應的是
A.CH2=CH2 + Br2→CH2BrCH2Br
B.2CH3CH2OH +O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
C.CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
D.CH4 + 2O2![]() CO2 + 2H2O
CO2 + 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下難溶鹽AgCl的飽和溶液中,![]() 與
與![]() 的物質的量濃度類似于水中
的物質的量濃度類似于水中![]() 和
和![]() 的關系,即
的關系,即![]() 常數),在下列溶液中:
常數),在下列溶液中:
a.![]()
![]() 溶液
溶液
b.![]()
![]() 鹽酸
鹽酸
c.![]()
d.![]() 溶液
溶液
則AgCl的溶解度由大到小的順序為( )
A.abcdB.cbadC.dcabD.cbda
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨是最重要的化工原料之一,自20世紀初以來,工業上合成氨主要依賴Haber-Bosch技術。探索新的合成氨的方法一直是重要課題。
(1)最新的“人工固氮”研究報道:在常溫、常壓、光照條件下,N2在催化劑表面與水發生反應,直接生成氨氣和氧氣。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
寫出上述固氮反應的熱化學方程式:_______________。
(2)恒溫、恒容條件下,在容器中模擬Haber-Bosch法合成氨,如下圖(圖中所示數據為初始物理量)。t分鐘后反應達到平衡,生成的NH3為0.4 mol。
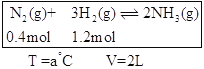
①判斷該容器中的反應達平衡的依據是_______(填字母)。
a.壓強不隨時間改變
b.氣體的密度不隨時間改變
c.c(N2)不隨時間改變
d.單位時間內生成2 mol NH3的同時消耗1 mol N2
e.單位時間內斷裂3 mol H-H鍵,同時斷裂6 mol N-H鍵
②該條件下容器中反應的平衡常數K=___;平衡時,混合氣體壓強p平=____(用初始壓強p0表示)。
(3)近期,兩位希臘化學家提出了電解合成氨的新思路:采用高質子導電性的SCY陶瓷(能傳遞H+)為介質,實現了高溫(570℃)常壓下高轉化率的電解法合成氨,轉化率可達到78%,裝置如圖:
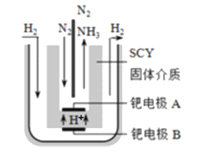
鈀電極A是電解池的_____極(填“陽”或“陰”),陰極反應式為________________________________。
(4)合成氨需要純凈的氮氣和氫氣,在制取原料氣的過程中,常混有一些雜質,其中的某些雜質會使合成氨的催化劑“中毒”,所以必須除去。例如,用稀氨水吸收H2S雜質:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若將標況下22.4L H2S通入1L 1mol/L NH3·H2O中進行吸收,則達到平衡時,H2S的吸收效率為_________%(結果保留兩位有效數字)。(注:吸收效率=c(H2S)已反應/c(H2S)總)(已知常溫下NH3·H2O的電離平衡常數Kb=2×10-5,H2S的電離平衡常數Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若將標況下22.4L H2S通入1L 1mol/L NH3·H2O中進行吸收,則達到平衡時,H2S的吸收效率為_________%(結果保留兩位有效數字)。(注:吸收效率=c(H2S)已反應/c(H2S)總)(已知常溫下NH3·H2O的電離平衡常數Kb=2×10-5,H2S的電離平衡常數Ka1 = 5×10-8,Ka2 = 7.1×10-15)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com