
| A. | 含1molFeCl3溶液水解生成1molFe(OH)3膠體后生成NA個膠體粒子 | |
| B. | 分子數為NA的N2,CO混合氣體體積為22.4L,質量為28g | |
| C. | 0.5molFeBr2與足量氯氣反應轉移的電子數為NA | |
| D. | 足量Zn與一定量的濃硫酸反應,產生22.4L標準狀況氣體時,轉移的電子數為2NA |
分析 A.氫氧化鐵膠體為多個離子的集合體;
B.氣體狀況未知;
C.氯氣足量二價鐵離子、溴離子都被氧化;
D.標準狀況下22.4L氣體的物質的量為1mol,足量鋅與濃硫酸反應生成的氣體組成為二氧化硫和氫氣,無論生成氫氣還是二氧化硫,生成1mol氣體都得到2mol電子.
解答 解:A.氫氧化鐵膠體為多個離子的集合體,所以含1molFeCl3溶液水解生成1molFe(OH)3膠體后生成小于NA個膠體粒子,故A錯誤;
B.氣體狀況未知,Vm不確定,無法計算混合氣體的物質的量和質量,故B錯誤;
C.0.5molFeBr2與足量氯氣反應,生成0.5mol三價鐵離子,失去0.5mol電子,生成1mol溴單質,失去1mol電子,所以共失去1.5mol電子,轉移電子數為:1.5NA,故C錯誤;
D.足量Zn與一定量的濃硫酸反應,產生的氣體為氫氣和二氧化硫的混合氣體,標準狀況下22.4L氣體的物質的量為1mol,生成1mol二氧化硫和氫氣的混合氣體,轉移了2mol電子,轉移的電子數為2NA,故D正確;
故選:D.
點評 本題考查了阿伏伽德羅常數的判斷及計算,注意明確標況下氣體摩爾體積的使用條件,掌握阿伏伽德羅常數與物質的量、摩爾質量等物理量之間的轉化關系,題目難度中等.


科目:高中化學 來源: 題型:多選題
| A. | 150 mL 1 mol•L-1的NaCl | B. | 75 mL 1.5mol•L-1的CaCl2 | ||
| C. | 150 mL 3 mol•L-1的KCl | D. | 75 mL 2 mol•L-1的NH4Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應的能量變化只表現為反應放熱或吸熱兩種形式 | |
| B. | 一個反應的反應物總能量大于生成物總能量,則該反應的焓變一定小于零 | |
| C. | 燃燒熱的大小與熱化學方程式中可燃物計量系數成正比 | |
| D. | 含1mol硫酸的稀溶液與足量NaOH稀溶液反應生成水所放出的熱量為中和熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化氫的摩爾質量為36.5g | |
| B. | 1mol H2SO4 的質量為98 g.mol-1 | |
| C. | 任何物質的摩爾質量都等于他的相對分子質量或相對原子質量 | |
| D. | CO2 的摩爾質量是H2 的摩爾質量的22倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,則可知C的燃燒熱為-110.5 kJ•mol-1 | |
| B. | 在101kPa下氫氣的燃燒熱△H=-285.8 kJ•mol-1,則水分解的熱化學方程式:2 H2O (l)=2H2 (g)+O2 (g)△H=+285.8 kJ•mol-1 | |
| C. | Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-2akJ•mol-1,則任何強酸和強堿發生中和反應生成1molH2O(l)的反應熱均為-akJ•mol-1 | |
| D. | 1g甲烷完全燃燒生成液態水的過程中放出55.6kJ熱量,則CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 原混合氣體的體積為1.1VL | |
| B. | 原混合氣體的體積為1.2VL | |
| C. | 反應達到限度時,氣體A消耗掉0.05 VL | |
| D. | 反應達到限度時,氣體B消耗掉0.05 VL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
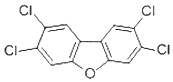 香港食環署食物安全中心日前宣布,兩個大閘蟹養殖場樣本,被驗出二噁英樣多氯聯苯含量超標.2,4,7,8-四氯二苯并呋喃是其中的一種,結構簡式如圖,下列有關該物質的說法正確的是( )
香港食環署食物安全中心日前宣布,兩個大閘蟹養殖場樣本,被驗出二噁英樣多氯聯苯含量超標.2,4,7,8-四氯二苯并呋喃是其中的一種,結構簡式如圖,下列有關該物質的說法正確的是( )| A. | 能發生氧化反應 | B. | 一溴取代物只有一種 | ||
| C. | 屬于氯代芳香烴 | D. | 易溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電子從K2FeO4電極沿導線移向Zn電極 | |
| B. | 正極反應式為2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 該電池放電過程中電解質溶液濃度不變 | |
| D. | 電池工作時OH-向負極遷移 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com