
【題目】(1)由金紅石TiO2制取單質Ti,涉及到的步驟為:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:① Cs+O2g=CO2g; H=3935 kJ·mol1
② 2COg+O2g=2CO2g; H=566 kJ·mol1
③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
則TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H= 。
(2)已知:①Zn(s)+1/2 O2(g)=ZnO(s);ΔH=-348.3 kJ/mol
②Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s);ΔH=-317.3 kJ/mol
則1 mol Ag(s)和足量O2(g)完全反應生成Ag2O(s)時,放出的熱量為 kJ。
【答案】
(1)80 kJ·mol1;(2)15.5;
【解析】
試題分析:(1)根據蓋斯定律①×2-②+③得TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)
△H=(-393.5kJmol-1)×2-(-566kJmol-1)+(+141kJmol-1),
即TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) △H=-80kJ/mol,故答案為:-80;
(2)已知:①Zn(s)+1/2 O2(g)=ZnO(s);ΔH=-348.3 kJ/mol,
②Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s);ΔH=-317.3 kJ/mol,
根據蓋斯定律,①-②得:2Ag(s) +1/2 O2(g)= Ag2O(s)
ΔH=(-348.3 kJ/mol)-(-317.3 kJ/mol)=-31 kJ/mol,則1 mol Ag(s)和足量O2(g)完全反應生成Ag2O(s)時,放出的熱量為15.5 kJ,故答案為:15.5。


科目:高中化學 來源: 題型:
【題目】將硫化氫通入碘水中發生反應,其化學方程式為H2S+I2=S+2HI,由此推斷出下列結論錯誤的是( )
A.硫是比碘強的還原劑 B.硫比碘更容易得到電子
C.碘是比硫較強的氧化劑 D.硫離子比碘離子更容易失電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個aL密閉容器中放入2mol A(氣)和1mol B(氣),在一定條件下發生下列反應:3A(氣)+B(氣) nC(氣)+2D(氣),達平衡后,A的濃度減少1/2,混和氣體的式量增大1/8,則n的值為( )
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列5種有機物的沸點按由高到低的順序排列正確的是( )
①2-甲基丁烷②2,2-二甲基丙烷③丙烷④四氯化碳⑤2-甲基丙烷
A. ①②③④⑤ B. ②③④⑤① C. ⑤②①③④ D. ④①②⑤③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,向2 L恒容密閉容器中充入1mol A,發生A(g) ![]() B(g) + C(g)反應。反應過程中c(C)隨時間變化的曲線如下圖所示,下列說法不正確的是( )
B(g) + C(g)反應。反應過程中c(C)隨時間變化的曲線如下圖所示,下列說法不正確的是( )
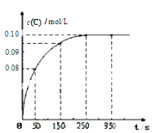
A.反應在 0 ~50 s 的平均速率v(C)=1.6×10-3mo1/(L s)
B.該溫度下,反應的平衡常數值為0.025
C.反應平衡后,再向容器中充入A、B、C各1mol,此時v(正)<v(逆)
D.保持其他條件不變,升高溫度,平衡時c(B)=0.11mol/L,則該反應的△H<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個密閉容器中,分別充有質量相同的甲、乙兩種氣體,若兩容器的溫度和壓強均相同,且甲的密度大于乙的密度,則下列說法正確的是( )
A.甲的分子數比乙的分子數多
B.甲的摩爾體積比乙的摩爾體積小
C.甲的物質的量比乙的物質的量少
D.甲的相對分子質量比乙的相對分子質量小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬冶煉和處理常涉及氧化還原反應。
(1)由下列物質冶煉相應金屬時采用電解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)輝銅礦(Cu2S)可發生反應 2Cu2S+2H2SO4+5O2==4CuSO4+2 H2O,該反應的還原劑是 ,當1mol O2發生反應時,還原劑所失電子的物質的量為 mol。
(3)如圖為電解精煉銀的示意圖, (填a或b)極為含有雜質的粗銀,若b極有少量紅棕色氣體生成,則生成該氣體的電極反應式為

(4)氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品。下圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過。

完成下列填空:
寫出電解飽和食鹽水的離子方程式 。
離子交換膜的作用為: 、 。
精制飽和食鹽水從圖中 位置補充,氫氧化鈉溶液從圖中 位置流出。(選填“a”、“b”、“c”或“d”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com