
| A. | R為ⅡA族元素 | B. | R(OH)4是強堿 | ||
| C. | RCl2有還原性,容易被氧化 | D. | R2+的硝酸鹽溶液呈中性 |
分析 已知R2+有5個電子層,其最外層有2個電子,則R原子最外層電子排布式為5s25p2,主族元素最外層電子數與其族序數相等,所以R屬于第IVA族,為Sn元素,當把固體SnCl2溶于水配制成溶液時,需加入少量的固體Sn單質和鹽酸,說明+2價Sn不穩定易被氧化,且該鹽是強酸弱堿鹽易水解,加入鹽酸能抑制其水解.
解答 解:已知R2+有5個電子層,其最外層有2個電子,則R原子最外層電子排布式為5s25p2,主族元素最外層電子數與其族序數相等,所以R屬于第IVA族,為Sn元素,當把固體SnCl2溶于水配制成溶液時,需加入少量的固體Sn單質和鹽酸,說明+2價Sn不穩定易被氧化,且該鹽是強酸弱堿鹽易水解,
A.由分析可知,R屬于第IVA族,故A錯誤;
B.當把固體SnCl2溶于水配制成溶液時,需加入少量的鹽酸,說明SnCl2是強酸弱堿鹽,易水解,所以Sn(OH)2是弱堿,R(OH)4也是弱堿,故B錯誤;
C.當把固體SnCl2溶于水配制成溶液時,需加入少量的固體Sn單質,說明+2價Sn不穩定易被氧化,故C正確;
D.SnCl2是強酸弱堿鹽,易水解而使其溶液呈酸性,故D錯誤;
故選C.
點評 本題考查了元素的推斷及元素周期律等知識點,先根據離子最外層電子排布式確定元素,再結合元素周期律、鹽類水解、氧化還原反應等知識點來分析解答,難度中等.


科目:高中化學 來源: 題型:選擇題
 最近有研究人員發現了一種處理高濃度乙醛廢水的新方法-隔膜電解法,乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸.實驗室以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置如圖所示.下列說法正確的是( )
最近有研究人員發現了一種處理高濃度乙醛廢水的新方法-隔膜電解法,乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸.實驗室以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置如圖所示.下列說法正確的是( )| A. | 若以CH4-空氣燃料電池為直流電源,燃料電池的b極應通入空氣 | |
| B. | 電解過程中,生成0.1 mol乙酸的同時,有0.2 mol的乙醇生成 | |
| C. | 陽極反應CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 電解過程中兩極除分別生成乙酸和乙醇外,均產生了無色氣體,則陽極產生的是O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯(硝基苯):加少量蒸餾水振蕩,靜置分層后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸餾 | |
| C. | CO2(HCl、水蒸氣):通過盛有堿石灰的干燥管 | |
| D. | 環己烷(苯):通入氫氣發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
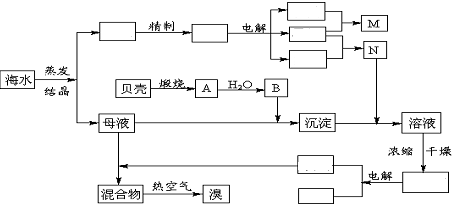
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Z>Y>X | |
| B. | Y元素在周期表中的位置為第三周期第IVA族 | |
| C. | 與氫氣化合時,Z比Y容易 | |
| D. | 甲中只含有離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
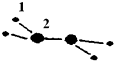 (1)M由兩種短周期元素組成,每個M分子含有18個電子,其分子球棍模型如圖所示.測得M的摩爾質量為32g/mol.畫出編號為2的原子結構示意圖:
(1)M由兩種短周期元素組成,每個M分子含有18個電子,其分子球棍模型如圖所示.測得M的摩爾質量為32g/mol.畫出編號為2的原子結構示意圖: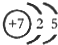 .
.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
| 實驗① | 等體積1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 實驗② | 等體積0.1mol/L氨水和1mol/L MgCl2溶液混合 | 無現象 |
| 實驗編號 | I-的初始濃度 (mol•L-1) | ClO-的初始濃度 (mol•L-1) | OH-的初始濃度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 離子 | 開始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com