
 如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容.據此下列說法錯誤的是( )
如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容.據此下列說法錯誤的是( )| A. | 該硫酸具有強烈的腐蝕性,應放于危險化學用品柜中妥善保管 | |
| B. | 取10 mL該硫酸于燒杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取該硫酸50 mL | |
| D. | 該硫酸與等質量的水混合所得溶液的物質的量濃度小于9.2 mol•L-1 |
分析 A.98%的硫酸為濃硫酸,具有強腐蝕性;
B.硫酸的密度大于水,等體積時硫酸溶液的質量大;
C.根據c=$\frac{1000ρω}{M}$計算濃硫酸的物質的量濃度,根據溶液稀釋前后溶質的物質的量不變計算;
D.硫酸與等質量的水混合所得溶液的體積大于硫酸體積的2倍.
解答 解:A.98%的硫酸為濃硫酸,具有強腐蝕性,屬于危險藥品,在實驗室中應妥善保管,故A正確;
B.硫酸的密度大于水,等體積時硫酸溶液的質量大,所配溶液的質量分數大于49%,故B錯誤;
C.該濃硫酸的物質的量濃度為c═$\frac{1000ρω}{M}$=$\frac{1000×1.84g/L×98%}{98g/mol}$=18.4mol/L,計算根據稀釋定律,稀釋前后溶質的物質的量不變,來計算濃硫酸的體積,設濃硫酸的體積為xmL,則xmL×18.4mol/L=200mL×4.6mol/L,解得:x=50,所以應量取的濃硫酸體積是50mL,故C正確;
D.該硫酸與等質量的水混合,由于硫酸密度大于水的密度,等質量混合時總體積大于硫酸體積的2倍,則所得溶液的物質的量濃度小于9.2 mol•L-1,故D正確;
故選B.
點評 本題考查物質的量濃度的計算,題目難度中等,注意硫酸密度比水大的特點,答題中注意把握相關計算公式的運用,試題側重考查學生的分析能力及化學計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
| 元素 | 相關信息 |
| X | X單質分子中σ鍵和π鍵數目之比為1:2 |
| Y | Y 基態原子的最外層電子排布式為 nsnnpn+2 |
| Z | Z的第一電離能在同周期主族元素中最小 |
| W | W的氧化物是導致酸雨的主要物質之一 |
| R | 基態原子的核外電子排布中未成對的電子數最多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. 也可與Ⅲ發生類似反應③的反應,生成有機物V,V的結構簡式是
也可與Ⅲ發生類似反應③的反應,生成有機物V,V的結構簡式是 .
.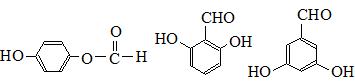 (任寫一種).
(任寫一種).查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
. .
. 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
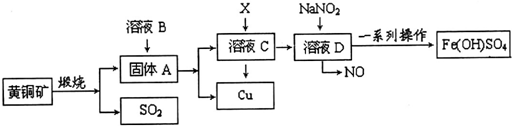

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com