
下列物質的應用不涉及氧化還原反應的是
| A.用稀硝酸洗去附在試管內壁的銀鏡 |
| B.用熱的純堿溶液清洗油污 |
| C.用新制的氫氧化銅懸濁液與病人的尿液混和加熱,來檢驗病人是否患糖尿病 |
| D.在鐵質鍍件上鍍銅 |
B
解析試題分析:稀硝酸具有氫氧化性,能氧化或腐蝕氫后不活潑金屬,即3Ag+4HNO3=3AgNO3+NO↑+2H2O,因此可用稀硝酸洗滌銀鏡,涉及氧化還原反應,故A選項錯誤;純堿為碳酸鈉,Na2CO3屬于強堿弱酸鹽,能水解,其溶液呈堿性,且其水解反應是吸熱反應,熱的純堿溶液堿性增強,能促進油脂水解且使反應速率加快,但上述變化不涉及氧化還原反應,故B選項正確;雖然新制氫氧化銅懸濁液是弱氧化劑,但能氧化葡萄糖,二者混合加熱時生成磚紅色沉淀,涉及氧化還原反應,故C選項錯誤;電鍍銅時,純銅作陽極,發生氧化反應,鐵質鍍件作陰極,銅鹽溶液為電鍍液,銅離子移向陰極并在陰極上得到電子,發生還原反應,析出銅覆蓋在鐵質鍍件上,因此涉及氧化還原反應,故D選項錯誤。
考點:考查考生對氧化還原反應概念及其本質、特征的理解;考查考生對常見氧化還原反應的熟悉程度及其在工業生產中的應用;考查考生對常見元素的單質和重要化合物的主要性質的掌握;考生考生對鹽類水解規律的了解;考查考生對油脂、葡萄糖的特征反應的了解程度。


科目:高中化學 來源: 題型:單選題
鈦被譽為“21世紀金屬”。工業冶煉鈦的第一步反應為:
TiO2+2C+2Cl2 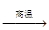 TiCl4+2CO。下列關于該反應的說法正確的是
TiCl4+2CO。下列關于該反應的說法正確的是
| A.TiO2是氧化劑 |
| B.氧化劑與還原劑的物質的量之比為1:1 |
| C.Cl2發生氧化反應 |
| D.當2 mol C參加反應時,轉移的電子數目為2 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
鉍(Bi)位于元素周期表中VA族,其價態為+3時較穩定,鉍酸鈉(NaBiO3)可氧化硫酸錳(MnSO4),反應的離子方程式為5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列說法錯誤的是
| A.若有0.1mol氧化產物生成,則轉移0.5mol電子 |
| B.鉍酸鈉難溶于水 |
| C.該反應可以用于鑒定Mn2+離子 |
| D.該反應可以用濃鹽酸酸化 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在碘酸鈉(NaIO3)的堿性溶液中通入Cl2,可以得到高碘酸鈉(Na2H3IO6)。下列有關該反應的說法正確的是
| A.該反應中Cl2作還原劑 |
| B.堿性條件下,NaIO3的氧化性強于Na2H3IO6 |
| C.反應中每生成1 mol Na2H3IO6,轉移2 mol電子 |
| D.反應中氧化產物與還原產物的物質的量之比為2 : 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在熔融KOH中大氣中的氧可將鉻鐵礦FeCr2O4中Fe和Cr的化合價都轉化為+6價,氧化 1 mol FeCr2O4在理論上需要多少摩爾氧氣
| A.2mol | B.2.5mol | C.3mol | D.4mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知5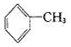 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列說法不正確的是
A.氧化產物為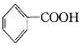 | B. 作氧化劑 作氧化劑 |
| C.每1mol KMnO4轉移5mol e- | D.H2SO4起酸的作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,當向含1 molFeBr2溶液中逐漸通入Cl2,溶液中有一半的Br-氧化時,下列判斷不正確的是
| A.反應前后溶液的顏色發生了改變 |
| B.反應后溶液中c(Cl-)= C(Br-) |
| C.參加反應的Cl2為1 mol |
| D.反應的離子方程式為:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)X、Y、Z、W、P為短周期的主族元素,其原子序數依次增大。Y、Z、W、P位于同一周期。X 元素形成的單質是自然界中含量最多的氣體,1mol Y的單質分別與足量鹽酸和氫氧化鈉溶液反應生成的氣體在標況下均為33.6L。W的原子最外層電子數與核外電子總數之比為3:8,X的原子序數是Z的原子序數的一半。
(1)Y在周期表中的位置是________;X的氫化物與P的氫化物接近時的現象是_________。
(2)W與P可形成原子個數比為1:2的化合物,其電子式為__________。
(3)Y與P形成的化合物溶液顯____性;用離子反應方程式表示顯這種性質的原因________________。
(4)Z、W、P三種元素的氣態氫化物穩定性由高到低的順序是______________________(填化學式)。
(5)X的三氟化物是微電子工業中優良的等離子刻蝕氣體,但在潮濕的環境中能與水發生反應生成無色氣體,遇空氣變為紅棕色。寫出此三氟化物與水反應的化學反應方程式_____,若0.6mol X的三氟化物完全與水反應,則轉移的電子總數約為_________個。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com