A、B、C、D為四種短周期元素,A、B、D的原子序數和原子半徑均依次增大,B、D同主族且能組成一種能形成“酸雨”的化合物.A、B可以形成A2B和A2B2的兩種通常情況下呈液態的共價化合物;B、C形成的兩種離子化合物溶于水,所得的溶液均呈強堿性;C的單質常溫下可與A2B劇烈反應.試回答下列問題:
(1)B、C兩元素以微粒個數比1:1形成的化合物X中,陰、陽離子個數比為 .
(2)在A2B2作用下,銅與稀硫酸制硫酸銅的化學反應的化學方程為: .
(3)表示形成DB2型“酸雨”的化學反應方程式有多個,請你選擇一個合適的反應,寫出這個反應的平衡常數表達式K= .
(4)已知常溫下 17gA、D兩元素組成的化合物與足量的DB2完全反應時放出熱量為a kJ,則該反應的熱化學方程式為 .
(5)已知 25℃時,Ksp(CaCO3)=1×10-9.Ksp(CaSO4)=9×10-6.長期使用的鍋爐需要定期除水垢,否則會降低燃料的利用率.水垢中含有的CaSO4,可先用Na2CO3溶液處理,使之轉化為疏松、易溶于酸的CaCO3,而后用酸除去.
①CaSO4轉化為CaCO3的離子方程式為 ;
②請分析CaSO4轉化為CaCO3的原理 .
【答案】
分析:B、D同主族且能組成一種能形成“酸雨”的化合物,該物質為SO
2,根據原子序數關系可知B為O元素,D為S元素,A、B可以形成A
2B和A
2B
2的兩種通常情況下呈液態的共價化合物,應為H
2O和H
2O
2,則A為H元素,B、C形成的兩種離子化合物溶于水,所得的溶液均呈強堿性;C的單質常溫下可與A
2B劇烈反應,即C與H
2O劇烈反應,兩種離子化合物分別是Na
2O、Na
2O
2,則C為Na元素,
(1)根據B、C兩元素以微粒個數比1:1形成的化合物為Na
2O
2分析;
(2)Cu和稀硫酸不反應,在具有強氧化性的H
2O
2作用下,發生反應生成CuSO
4;
(3)以反應2SO
2+O
2
2SO
3為例,根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積判斷;
(4)根據反應的化學方程式為2H
2S+SO
2═3S+2H
2O,結合物質的量計算;
(5)從沉淀的轉化的角度分析.
解答:解:B、D同主族且能組成一種能形成“酸雨”的化合物,該物質為SO
2,根據原子序數關系可知B為O元素,D為S元素,A、B可以形成A
2B和A
2B
2的兩種通常情況下呈液態的共價化合物,應為H
2O和H
2O
2,則A為H元素,B、C形成的兩種離子化合物溶于水,所得的溶液均呈強堿性;C的單質常溫下可與A
2B劇烈反應,即C與H
2O劇烈反應,兩種離子化合物分別是Na
2O、Na
2O
2,則C為Na元素,則
(1)B、C兩元素以微粒個數比1:1形成的化合物為Na
2O
2,其中陽離子為Na
+,陰離子為O
22-,陰、陽離子個數比為1:2,故答案為:1:2;
(2)Cu和稀硫酸不反應,在具有強氧化性的H
2O
2作用下,發生反應生成CuSO
4,反應的化學方程式為Cu+H
2SO
4+H
2O
2=CuSO
4+2H
2O,
故答案為:Cu+H
2SO
4+H
2O
2=CuSO
4+2H
2O;
(3)以反應2SO
2+O
2
2SO
3為例,反應的平衡常數為k=
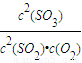
,故答案為:
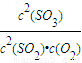
;
(4)A、D兩元素組成的化合物與足量的DB
2完全反應的化學方程式為2H
2S+SO
2═3S+2H
2O,n(H
2S)=
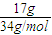
=0.5mol,
則4molH
2S參加反應生成液態水放出的熱量為4akJ,
所以熱化學方程式為2H
2S(g)+SO
2(g)═3S(s)+2H
2O(l)△H=-4a kJ/mol,
故答案為:2H
2S(g)+SO
2(g)═3S(s)+2H
2O(l)△H=-4a kJ/mol;
(5)加入Na
2CO
3溶液后,CO
32-與Ca
2+結合,轉化為Ksp更小的CaCO
3沉淀,使CaSO
4的沉淀溶解平衡向溶解方向移動,反應的離子方程式為CaSO
4(s)+CO
32-(aq)=CaCO
3(s)+SO
42-(aq),CaCO
3疏松、易溶于酸,從而除去水垢,
故答案為:CaSO
4(s)+CO
32-(aq)=CaCO
3(s)+SO
42-(aq);加入Na
2CO
3溶液后,CO
32-與Ca
2+結合,轉化為Ksp更小的CaCO
3沉淀,使CaSO
4的沉淀溶解平衡向溶解方向移動.
點評:本題考查較為綜合,設計元素的推斷、離子的組成、物質的性質以及熱化學方程式等問題,題目難度中等,易錯點為(5),注意從沉淀轉化的角度分析.

 2SO3為例,根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積判斷;
2SO3為例,根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積判斷; 2SO3為例,反應的平衡常數為k=
2SO3為例,反應的平衡常數為k=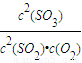 ,故答案為:
,故答案為: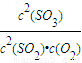 ;
;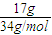 =0.5mol,
=0.5mol,

 桃李文化快樂暑假武漢出版社系列答案
桃李文化快樂暑假武漢出版社系列答案 優秀生快樂假期每一天全新寒假作業本系列答案
優秀生快樂假期每一天全新寒假作業本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案

