
【題目】據圖回答下列問題:

(1)若燒杯中溶液為稀硫酸,則觀察到的現象是_______________,電流表指針____(填“偏轉”或“不偏轉”),兩極反應式為:正極_______________;負極______________________。
(2)若燒杯中溶液為氫氧化鈉溶液,則負極為________(填Mg或Al),總反應方程式為______。
(3)美國阿波羅宇宙飛船上使用了一種新型裝置,其構造如下圖所示:A、B兩個電極均由多孔的碳塊組成。該電池的正極反應式為:___________________________。
 .
.
【答案】 鎂逐漸溶解,鋁上有氣泡冒出 偏轉 2H++2e-===H2↑ Mg-2e-===Mg2+ Al 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ O2+2H2O+4e-===4OH-
【解析】根據自發的氧化還原反應能設計成原電池,失電子的一極是負極,發生氧化反應,得到電子的是正極,發生還原反應;在燃料電池中,通入正極的一極氧氣,通入負極的一極氧氣是燃料,負極的電極反應=總反應-正極的電極反應和。
(1)鎂、鋁和稀硫酸構成了原電池,自發進行的反應是鎂和硫酸反應,金屬鎂做負極,
電極反應:Mg-2e-=Mg2+,金屬鋁為正極,溶液中的H+得到電子發生還原反應,電極反應為:2H++2e-=H2↑,所以可看到鎂逐漸溶解,鋁極上有氣泡冒出,電流表指針發生偏轉,故答案為:鎂逐漸溶解,鋁極上有氣泡冒出;電流表指針發生偏轉;2H++2e-=H2↑;Mg-2e-=Mg2+;(2)鎂、鋁和氫氧化鈉溶液構成了原電池,自發的氧化還原反應是金屬鋁和氫氧化鈉之間的反應,總反應方程式為:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,鋁失電子,為負極,金屬鎂作正極;(3)氫氣、氧氣和氫氧化鉀溶液構成了原電池,自發的氧化還原反應是氫氣和氧氣之間的反應,總反應方程式為:2H2+O2=2H2O,正極上通的是氧氣,B極是正極,電極反應:O2+2H2O+4e-=4OH-。


科目:高中化學 來源: 題型:
【題目】圣路易斯大學研制的新型乙醇燃料電池,使用能傳遞質子(H+)的介質作溶劑,反應原理為C2H5OH+3O2→2CO2+3H2O,下圖是該電池的示意圖,下列說法正確的是

A. a極為電池的正極
B. 電池工作時,電流由a極沿導線經燈泡再到b極
C. 電池正極的電極反應為:4H++O2+4e-═2H2O
D. 電池工作時,1mol乙醇被氧化,則電路中有6mol電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N4分子結構為正四面體(如圖所示)。已知:斷裂N4(g)中1 molN-N鍵吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列說法正確的是
N放出941 kJ能量。下列說法正確的是

A. N4(g)比N2(g)更穩定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化學鍵放出193 kJ的能量
D. lmolN2(g)完全轉化為N4(g),體系的能量增加362kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 實驗室采用如圖所示裝置制備乙酸乙酯,實驗結束后,取下盛有飽和碳酸鈉溶液的試管,再沿該試管內壁緩緩加入紫色石蕊試液1毫升,發現紫色石蕊試液存在于飽和碳酸鈉溶液層與乙酸乙酯液層之間(整個過程不振蕩試管),下列有關該實驗的描述,不正確的是( )

A.制備的乙酸乙酯中混有乙酸和乙醇雜質
B.該實驗中濃硫酸的作用是催化和吸水
C.飽和碳酸鈉溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
D.石蕊層為三層環,由上而下是藍、紫、紅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生物體的生命活動離不開水。下列關于水的敘述,錯誤的是
A. 在最基本生命系統中,H20有自由水和結合水兩種存在形式
B. 由氨基酸形成多肽鏈時,生成物H20中的氫來自氨基和羧基
C. 玉米體細胞中含量最多的有機物是水
D. 細胞內的水能參與營養物質的運輸,也能作為細胞內化學反應的反應物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學用語表示正確的是( )
A.﹣CHO的電子式: ![]()
B.丙烷分子的比例模型為: ![]()
C.2﹣乙基﹣1,3﹣丁二烯的鍵線式: ![]()
D.對硝基甲苯的結構簡式: ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗室產生的廢液中含有Fe3+、Cu2+、Ba2+、Cl﹣四種離子,現設計下列方案對廢液進行處理,以回收金屬并制備氯化鋇、氯化鐵晶體. 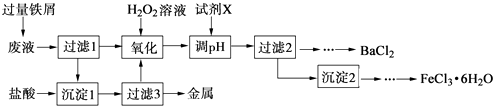
(1)沉淀1中含有的金屬單質是 .
(2)氧化時加入H2O2溶液發生反應的離子方程式為 .
(3)下列物質中,可以作為試劑X的是(填字母).
A.BaCl2
B.BaCO3
C.NaOH
D.Ba(OH)2
(4)檢驗沉淀2洗滌是否完全的方法是 .
(5)制備氯化鐵晶體過程中需保持鹽酸過量,其目的是 .
(6)由過濾2得到的濾液制備BaCl2的實驗操作依次為、冷卻結晶、、洗滌、干燥.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com