
【題目】常溫下,在下列各組指定溶液中一定不能大量共存的離子組的個數是( )
①強酸性溶液中:Mg2+、K+、![]() 、
、![]()
②強堿性溶液中:Na+、Ba2+、![]() 、
、![]()
③在無色溶液中:H+、K+、![]() 、F-
、F-
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、![]() 、Cl-
、Cl-
⑤無色透明溶液中:![]() 、K+、Cl-、
、K+、Cl-、![]()
⑥無色透明的堿性溶液中:Na+、Ba2+、Cl-、![]()
A.一個B.兩個C.三個D.四個
【答案】C
【解析】
①強酸性溶液中氫離子濃度大于氫氧根離子濃度:Mg2+、K+、SO42-、NO3-四種離子之間不反應,和氫離子之間也不反應,可以大量共存,故①不符合題意;
②強堿性溶液中氫氧根離子濃度大于氫離子濃度:Na+、Ba2+、HCO3-、NO3-中,HCO3-與OH-反應生成CO32-,不能大量共存,故②符合題意;
③在無色溶液中:H+、K+、SO42-、F-中,F-與H+生成氫氟酸,不能大量共存,故③符合題意;
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、SO42-、Cl-中,Ba2+與SO42 –會生成硫酸鋇沉淀,在溶液中不能大量共存,故④符合題意;
⑤無色透明溶液中:SO42-、K+、Cl-、NO3-離子間不發生反應,可以大量共存,故⑤不符合題意;
⑥無色透明的堿性溶液中:Na+、Ba2+、NO3-、Cl-離子間不發生化學反應,可以大量共存,故⑥不符合題意;
②③④符合題意,C可選;
答案選C。


科目:高中化學 來源: 題型:
【題目】用如圖所示裝置進行下列實驗,實驗結果與預測的現象不一致的是( )
①中的物質 | ②中的物質 | 預測①的現象 | |
A | 淀粉KI溶液 | 濃硝酸 | 無明顯變化 |
B | 酚酞溶液 | 濃鹽酸 | 無明顯變化 |
C | MgCl2溶液 | 濃氨水 | 有白色沉淀 |
D | 濕潤紅紙條 | 飽和氯水 | 紅紙條褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應原理在生產生活和科學研究中應用廣泛。
(1)下列表述中沒有氧化還原反應發生的是_____。
a.滴水成冰 b.蠟炬成灰 c.百煉成鋼
(2)NH3和Cl2反應的方程式為:NH3+Cl2—N2+HCl
①該反應中被氧化的元素是___(填元素名稱),氧化劑是__(填化學式)。
②配平該方程式:____NH3+ ____Cl2—____N2+____HCl
③工業生產中常用噴灑氨水的方法來檢查是否有Cl2泄漏,若Cl2有泄漏,可以觀察到的現象是______,產生該現象的反應方程式為___。
(3)“地康法”制氯氣的反應原理圖示如下:
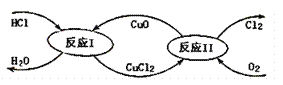
①反應I的化學方程式為____。
②若要制得標準狀況下氯氣11.2L,則整個反應中轉移電子的物質的量為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】18.4g由鐵、銅組成的混合粉末加入100mL5.0molL﹣1FeCl3溶液中,充分反應后,剩余固體質量為3.2g。下列說法正確的是( )
A.原固體混合物中:n(Cu):n(Fe)=2:1
B.反應后溶液中的溶質有FeCl2、FeCl3、CuCl2
C.反應后溶液中:n(Fe2+)+n(Cu2+)=0.8mol
D.剩余固體是鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅是一種重要的化工產品,常用作有機合成催化劑,還可用于顏料、防腐等工業,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于濃鹽酸和氨水,在潮濕空氣中易水解氧化成綠色的堿式氯化銅[Cu2(OH)4-nCln],隨著環境酸度的改變n隨之改變。以海綿銅(主要成分是Cu和少量CuO)為原料,采用硝酸銨氧化分解技術生產CuCl的工藝過程如下:

(1)寫出溶解過程中產生無色氣體的化學式:_______。
(2)還原過程中發生的主要反應的離子方程式:______。
(3)析出的CuCl晶體水洗后要立即用無水乙醇洗滌,在真空干燥機內于70℃ 干燥2h,冷卻密封包裝。70℃, 真空干燥、密封包裝的原因是:______。
(4)濾液中主要成分是(NH4)2SO4,工業上用(NH4)2SO4與Al2(SO4)3制取銨明礬,銨明礬在食品,制革等方面有重要用途,寫出銨明礬的化學式________。
(5)隨著pH值減小[Cu2(OH)4-nCln]中Cu%_______。(填字母)
A.增大 B.不變 C.不能確定 D.減小
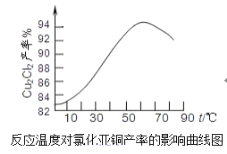
(6)如圖是各反應物在最佳配比條件下,反應溫度對CuCl產率影響。由圖可知,溶液溫度控制在60℃時,CuCl產率能達到94%,當溫度高于65 時,CuCl產率會下降,從生成物的角度分析,其原因可能是______。
(7)以碳棒為電極電解CuCl2溶液也可得到CuCl,寫出電解時陰極上發生的電極反應式:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】VL濃度為0.5mol·L-1的鹽酸,欲使其濃度增大1倍,采取的措施合理的是( )
A.通入標準狀況下的HCl氣體11.2VL
B.將溶液加熱濃縮到0.5VL
C.加入10mol.L-1的鹽酸0.1VL,再稀釋至1.5VL
D.加入VL1.5mol.L-1的鹽酸混合均勻
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(AlN)是一種新型無機材料,廣泛應用于集成電路生產領域。某化學研究小組利用氮氣、氧化鋁和活性炭在高溫下制取氮化鋁。 請回答下列問題:
(1)請寫出制取氮化鋁的化學方程式________。
制得的AlN樣品僅含有Al2O3雜質,已知:AlN+NaOH+H2O=NaAlO2+NH3↑為測定AlN含量,設計如下三種實驗方案。(測定過程均忽略NH3在強堿溶液中的溶解)
(方案1)取一定量的樣品,用以下裝置測定樣品中AlN的純度(夾持裝置已略去)。
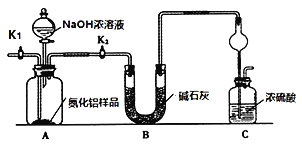
實驗步驟:組裝好實驗裝置,檢查裝置氣密性并加入實驗藥品,關閉K1,打開K2 ,打開分液漏斗活塞,加入NaOH濃溶液,至不再產生氣體。打開K1,通入氮氣一段時間,測定C裝置反應前后的質量變化。
(2)圖中C裝置中球形干燥管的作用是________。
(3)通入氮氣的目的是_______。
(4)圖中裝置會導致測定結果_______(填“偏高”“偏低”或“無影響”)。
(方案2)用如圖裝置測定mg樣品中AlN的純度(部分夾持裝置已略去)。
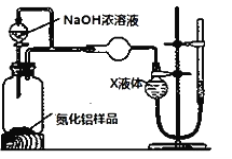
(5)為測定生成氣體的體積,量氣裝置中的X液體可以是___(填字母)
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(6)若mg樣品完全反應,測得生成氣體的體積為VmL(已轉換為標準狀況),則AlN的質量分數是______。若其他操作均正確,但反應結束后讀數時,右側量氣管中液面高于左側球型管中液面,則最后測得AlN的質量分數會_____(填“偏高”“偏低”或“無影響”)。
(方案3)按以下步驟測定樣品中A1N的純度:(過濾時使用無灰濾紙過濾)
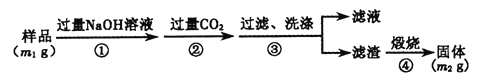
(7)步驟②生成沉淀的離子方程式為_______。
(8)樣品中A1N的質量分數為_______(用含m1、m2的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應H2(g)+I2(g)![]() 2HI(g),在溫度一定下由H2(g)和I2(g)開始反應,下列說法正確的是( )
2HI(g),在溫度一定下由H2(g)和I2(g)開始反應,下列說法正確的是( )
A.H2(g)的消耗速率與HI(g)的生成速率之比為2:1
B.反應進行的凈速率是正、逆反應速率之差
C.正、逆反應速率的比值是恒定的
D.壓強不變時,反應達到平衡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】學習小組研究鈉的燃燒反應產物,取金屬鈉(表面已被氧化),吸干煤油,置于坩堝內,上方倒扣盛滿O2集氣瓶,加熱一段時間,充分反應后觀察到產物為白色固體和淡黃色固體的混合物,測得反應前后各物質的質量如下表:
質量/g | ||
反應前 | 坩堝 | 100 |
盛有金屬鈉的坩堝 | 105.4 | |
反應后 | 盛有固體產物的坩堝 | 107.4 |
請回答下列問題:
(1)根據實驗現象,推測固體產物成分為___________________(填化學式)
(2)將產物全部溶于水,觀察到有氣泡生成,寫出該反應的化學方程式為________。
(3)測得上述溶液中n(Na+)=0.2mol,通過計算證實加熱過程中存在表面的Na2O轉化為Na2O2。___________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com