
A、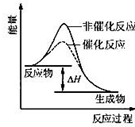 表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化 表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化 | B、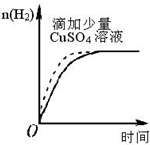 表示常溫下,等量鋅粉與足量的等濃度的鹽酸反應(滴加CuSO4溶液的為虛線) 表示常溫下,等量鋅粉與足量的等濃度的鹽酸反應(滴加CuSO4溶液的為虛線) | C、 表示 KNO3的溶解度曲線,a點所示的溶液是 80℃時 KNO3 的不飽和溶液 表示 KNO3的溶解度曲線,a點所示的溶液是 80℃時 KNO3 的不飽和溶液 | D、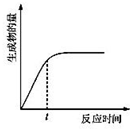 表示某可逆反應生成物的量隨反應時間變化的曲線,t 時反應物轉化率最大 表示某可逆反應生成物的量隨反應時間變化的曲線,t 時反應物轉化率最大 |


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
A、圖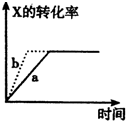 所示,反應:X(g)+2Y(g)?3Z(g),b的壓強一定比a大 所示,反應:X(g)+2Y(g)?3Z(g),b的壓強一定比a大 | B、圖 表明合成氨反應是放熱反應,b表示在反應體系中加入了催化劑 表明合成氨反應是放熱反應,b表示在反應體系中加入了催化劑 | C、圖 所示,t1℃時質量分數均為20%的甲乙兩種溶液,升溫到t2℃時,兩種溶液中溶質的質量分數仍然相等 所示,t1℃時質量分數均為20%的甲乙兩種溶液,升溫到t2℃時,兩種溶液中溶質的質量分數仍然相等 | D、圖 所示,用水稀釋PH相同的鹽酸和醋酸,Ⅰ表示醋酸,Ⅱ表示鹽酸,且溶液導電性:c>b>a 所示,用水稀釋PH相同的鹽酸和醋酸,Ⅰ表示醋酸,Ⅱ表示鹽酸,且溶液導電性:c>b>a |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com