
| l離子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 濃度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
| 物質 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
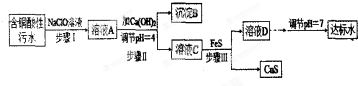
分析 含銅酸性污水加入次氯酸鈉,次氯酸根離子具有氧化性,氧化污水中具有還原性的亞鐵離子2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,溶液A主要含有鐵離子、銅離子、氯離子等,步驟Ⅱ加入氫氧化鈣,調節PH=4,生成氫氧化鐵沉淀,沉淀B為Fe(OH)3,溶液C中主要含有銅離子、氯離子等,步驟Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,亞鐵離子轉化成氫氧化鐵進行回收,溶液D調節PH=7,處理成達標水.
(1)根據含銅酸性污水c(H+)=0.1mol/L,pH=-lg[c(H+)]分析;
(2)含銅酸性污水加入次氯酸鈉,次氯酸根離子具有氧化性,氧化污水中具有還原性的亞鐵離子,兩者發生氧化還原反應;
(3)步驟Ⅱ加入氫氧化鈣,調節PH=4,使Fe(OH)3沉淀完全,防止步驟Ⅲ中加入FeS過量溶解;
(4)步驟Ⅱ中只需加入Ca(OH)2調節溶液的pH=7,c(OH-)=10-7mol/L,根據Cu(OH)2存在如下平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),計算c(Cu2+);
(5)步驟Ⅲ中加入FeS,硫化亞鐵和銅離子發生復分解反應,該過程不選用易溶的Na2S,Na2S價格高且引入過多雜質離子;
(6)沉淀B為Fe(OH)3,步驟Ⅲ中加入FeS,得到CuS,亞鐵離子轉化成氫氧化鐵進行回收;
解答 解:含銅酸性污水加入次氯酸鈉,次氯酸根離子具有氧化性,氧化污水中具有還原性的亞鐵離子2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,溶液A主要含有鐵離子、銅離子、氯離子等,步驟Ⅱ加入氫氧化鈣,調節PH=4,生成氫氧化鐵沉淀,沉淀B為Fe(OH)3,溶液C中主要含有銅離子、氯離子等,步驟Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,溶液D調節PH=7,處理成達標水.
(1)含銅酸性污水c(H+)=0.1mol/L,pH=-lg[c(H+)]=-lg[0.1]=1,
故答案為:1;
(2)含銅酸性污水加入次氯酸鈉,次氯酸根離子具有氧化性,氧化污水中具有還原性的亞鐵離子2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案為:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3)Fe(OH)3存在如下平衡:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq),Fe(OH)3飽和溶液中c(Fe3+)=0.04mol•L-1,Fe(OH)3?Fe3++3OH-生成的氫氧根c(OH-)=0.12mol/L,c(H+)=$\frac{1{0}^{-14}}{0.12}$mol/L≈8.3×10-12mol/L,PH=12-lg8.3,步驟Ⅱ加入氫氧化鈣,調節PH=4,使Fe(OH)3沉淀完全,FeS能溶于pH<4的酸性溶液,防止步驟Ⅲ中加入FeS過量溶解,
故答案為:使沉淀完全,防止沉淀,防止FeS溶解;
(4)步驟Ⅱ中只需加入Ca(OH)2調節溶液的pH=7,c(OH-)=10-7mol/L,Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),氫氧化銅沉淀,溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于國家規定的排放標準c(Cu2+)≤1.0×10-7mol•L-1,所以不合理,
故答案為:不合理;pH=7時溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于國家規定的排放標準c(Cu2+)≤1.0×10-7mol•L-1;
(5)步驟Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,該過程不選用易溶的Na2S,Na2S價格高且引入過多雜質離子鈉離子和硫離子,
故答案為:Cu2++FeS=CuS+Fe2+;Na2S價格高且引入過多雜質離子;
(6)調節PH=4,沉淀B為Fe(OH)3,步驟Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,亞鐵離子轉化成氫氧化鐵進行回收,上述整個處理工藝中,可以回收的金屬化合物有Fe(OH)3、CuS,
故答案為:Fe(OH)3、CuS.
點評 本題考查了工藝流程圖的分析判斷,解答本題要充分理解各種物質的性質,從而得出正確的結論,應熟悉混合物的分離方法,掌握沉淀與PH關系是解答關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | R的最高價氧化物對應的水化物的酸性比X的弱 | |
| B. | 非金屬性:Y>X | |
| C. | 原子半徑的大小順序:X>Z | |
| D. | Z元素最高價氧化物對應的水化物具有兩性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
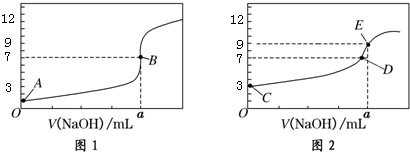
| A. | 圖1是滴定CH3COOH 溶液的曲線 | |
| B. | 圖2若用甲基橙作指示劑達到滴定終點時,則溶液由黃色變為紅色 | |
| C. | 點D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E兩點對應的pH分別為3、9,則水電離的氫離子濃度之比為1:100 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
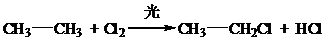 、取代反應
、取代反應 、取代反應.
、取代反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 D
D
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中不一定含有金屬元素 | |
| B. | 由不同原子所形成的純凈物不一定是化合物 | |
| C. | 分子中一定含有化學鍵 | |
| D. | 含有金屬元素的離子不一定是陽離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com