
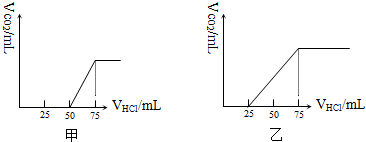
分析 當生成CO2氣體時,發生反應NaHCO3+HCl=NaCl+H2O+CO2↑.
(1)甲中生成CO2氣體至最大,消耗HCl為25mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,中和NaOH消耗HCl的體積為50mL-25mL=25mL,根據反應消耗鹽酸的體積計算NaOH、Na2CO3的物質的量之比;
(2)乙中生成CO2氣體至最大,消耗HCl為50mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為50mL,而圖象中開始生成CO2氣體時消耗HCl體積為25mL,說明該階段只發生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳與NaOH反應后溶液中含NaHCO3、Na2CO3,從25mL~75mL消耗50mL鹽酸時生成的二氧化碳,根據方程式進而計算生成二氧化碳的體積;
(3)加入75mL鹽酸時,溶液中溶質都恰好完全反應,此時溶液為NaCl溶液,根據守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl),進而計算原氫氧化鈉溶液的濃度.
解答 解:當生成CO2氣體時,發生反應NaHCO3+HCl=NaCl+H2O+CO2↑.
(1)甲中生成CO2氣體至最大,消耗HCl為25mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,中和NaOH消耗HCl的體積為50mL-25mL=25mL,
由方程式可知NaHCO3和Na2CO3的物質的量之比等于兩個過程分別消耗鹽酸的體積之比,故NaOH、Na2CO3的物質的量之比=25mL:25mL=1:1;
故答案為:NaOH、Na2CO3,1:1;
(2)乙中生成CO2氣體至最大,消耗HCl為50mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為50mL,而圖象中開始生成CO2氣體時消耗HCl體積為25mL,說明該階段只發生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳與NaOH反應后溶液中含NaHCO3、Na2CO3;從25mL~75mL消耗50mL鹽酸時生成的二氧化碳,該階段生成二氧化碳為0.05L×0.1mol/L=0.005mol,體積為0.005mol×22.4L/mol=0.112L=112mL,
故答案為:NaHCO3、Na2CO3;112mL;
(3)加入75mL鹽酸時,溶液中溶質都恰好完全反應,此時溶液為NaCl溶液,根據守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氫氧化鈉溶液的濃度=$\frac{0.0075mol}{0.01L}$=0.75mol/L,
故答案為:0.75mol/L.
點評 本題考查混合物的計算,根據消耗鹽酸的體積分析圖象中各階段發生的反應,進而判斷氫氧化鈉與二氧化碳反應的溶質是關鍵,題目難度較大,側重于考查學生的分析能力和計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$\stackrel{濃硫酸、170℃}{→}$CH2═CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| B. | CH3CH2Br$\stackrel{Br}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| C. | CH3CH2Br $\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
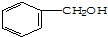 的含氧官能團是-OH;此醇在一定條件下被氧氣催化氧化的方程式2
的含氧官能團是-OH;此醇在一定條件下被氧氣催化氧化的方程式2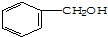 +O2$→_{△}^{催化劑}$2
+O2$→_{△}^{催化劑}$2 +2H2O;
+2H2O;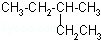 的系統命名為3-甲基戊烷.
的系統命名為3-甲基戊烷.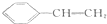 )中最多有8碳原子在同一個平面里
)中最多有8碳原子在同一個平面里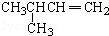 與溴水、HCl(寫主反應)在一定條件下反應的方程式
與溴水、HCl(寫主反應)在一定條件下反應的方程式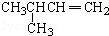 +Br2→CH3CH(CH3)CHBr-CH2Br;
+Br2→CH3CH(CH3)CHBr-CH2Br;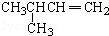 +HCl→CH3CH(CH3)CHCl-CH3;
+HCl→CH3CH(CH3)CHCl-CH3;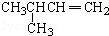 $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$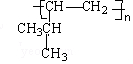 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,2H2+O2$\frac{\underline{\;點燃\;}}{\;}$2H2O | |
| B. | NH3+CO2+H2O═NH4HCO3,NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑ | |
| C. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI,2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+I2↑ | |
| D. | 2Ag+Br2$\frac{\underline{\;CuO\;}}{\;}$2AgBr,2AgBr$\frac{\underline{\;光\;}}{\;}$2Ag+Br2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X的氫化物溶液與其最高價氧化物對應的水化物溶液的酸堿性相反 | |
| B. | Y的氧化物既可與強酸反應又可與強堿反應,并可用來制作耐火材料 | |
| C. | X和Z的最高價氧化物對應的水化物的濃溶液都是具有強氧化性的酸 | |
| D. | 因為Z的氫化物相對分子質量大于X的氫化物,其熔沸點較高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣不能使干燥的有色布條褪色,液氯能使干燥的有色布條褪色 | |
| B. | 實驗室制取氯氣時,常用飽和石灰水來吸收多余的氯氣 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料有機色素褪色 | |
| D. | 氯氣可用于自來水消毒,因其反應產生次氯酸能殺死細菌 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
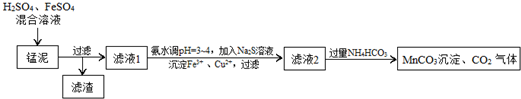
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com