
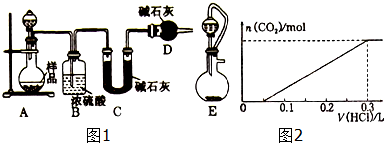
分析 小蘇打久置會發生反應:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,該樣品成分為NaHCO3、Na2CO3,測定樣品中純堿的質量分數方法有:測定二氧化碳的質量、測定碳酸鈉的質量、測定碳酸氫鈉的質量.
(1)①使用玻璃棒攪拌,避免局部溫度過高而是固體飛濺;
②加熱至恒重的目的是使NaHCO3分解完全,并使水完全揮發;
③加熱碳酸氫鈉分解生成碳酸鈉,即樣品由NaHCO3、Na2CO3的混合物轉化為Na2CO3,根據固體質量差,利用方程式利用差量法計算樣品中碳酸氫鈉的質量,進而計算碳酸鈉計算碳酸鈉的質量分數;
(2)①利用C中堿石灰增重測定反應生成二氧化碳的質量,進而計算樣品中碳酸鈉的質量分數,由于堿石灰可以吸收空氣中的二氧化碳與水蒸氣,故D裝置的作用是避免空氣中的二氧化碳與水蒸氣加入C中;
②C裝置反應前后質量之差為反應生成二氧化碳的質量,根據樣品總質量、二氧化碳的質量可以計算混合物中碳酸鈉的質量;
③E裝置用恒壓分液漏斗,部分二氧化碳為殘留在分液漏斗上部,使C中吸收二氧化碳質量減小;
(4)由圖可知,開始發生反應:Na2CO3+HCl=NaHCO3,產生二氧化碳的反應為:HCl+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+CO2↑+H2O,橫坐標每個刻度為50mL,令每個刻度為1molHCl,根據方程式計算碳酸鈉的物質的量,再計算樣品中碳酸氫鈉的物質的量,進而計算碳酸鈉的質量分數.
解答 解:小蘇打久置會發生反應:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,該樣品成分為NaHCO3、Na2CO3,測定樣品中純堿的質量分數方法有:測定二氧化碳的質量、測定碳酸鈉的質量、測定碳酸氫鈉的質量.
(1)①使用玻璃棒攪拌,使固體受熱均勻,避免局部溫度過高,造成固體外濺,
故答案為:使固體受熱均勻,避免局部溫度過高,造成固體外濺;
②加熱至恒重的目的是使NaHCO3分解完全,并使水完全揮發,即樣品由NaHCO3、Na2CO3的混合物轉化為Na2CO3,
故答案為:使NaHCO3分解完全,并使水完全揮發;
③設樣品中碳酸氫鈉的質量為x,則:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 質量減少
168 62
x (m-a)g
則x=$\frac{168(m-a)g}{62}$=$\frac{84(m-a)}{31}$g,故m(Na2CO3)=[m-$\frac{84(m-a)}{31}$]g,
則樣品中Na2CO3的質量分數為{[m-$\frac{84(m-a)}{31}$]g÷mg}×100%=$\frac{84a-53m}{31m}$×100%,
故答案為:$\frac{84a-53m}{31m}$×100%;
(2)①利用C中堿石灰增重測定反應生成二氧化碳的質量,進而計算樣品中碳酸鈉的質量分數,由于堿石灰可以吸收空氣中的二氧化碳與水蒸氣,故D裝置的作用是吸收空氣中的二氧化碳與水蒸氣,避免空氣中的二氧化碳與水蒸氣加入C中,防止測定誤差,
故答案為:吸收空氣中的二氧化碳與水蒸氣,避免空氣中的二氧化碳與水蒸氣加入C中;
②C裝置反應前后質量之差為反應生成二氧化碳的質量,根據樣品總質量、二氧化碳的質量可以計算混合物中碳酸鈉的質量,還需分別稱量C裝置反應前、后的質量,
故答案為:C;
③E裝置用恒壓分液漏斗,部分二氧化碳為殘留在分液漏斗上部,使C中吸收二氧化碳質量減小,造成較大的誤差,
故答案為:E裝置用恒壓分液漏斗,部分二氧化碳為殘留在分液漏斗上部,使C中吸收二氧化碳質量減小,造成較大的誤差;
(4)由圖可知,開始發生反應:Na2CO3+HCl=NaHCO3,產生二氧化碳的反應為:HCl+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+CO2↑+H2O,橫坐標每個刻度為50mL,令每個刻度為1molHCl,由方程式可知,樣品中n(Na2CO3)=1mol,碳酸鈉反應生碳酸氫鈉為1mol,故原樣品中碳酸氫鈉的物質的量為5mol-1mol=4mol,則原混合物中碳酸鈉的質量分數為$\frac{1mol×106g/mol}{1mol×106g/mol+4mol×84g/mol}$×100%=23.98%,
故答案為:23.98%.
點評 本題考查物質組成含量的測定,明確實驗原理是解題關鍵,是對學生綜合能力的考查,難度中等,注意方案二有一定的缺陷,裝置中的二氧化碳未能完全被C中堿石灰吸收.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將等物質的量的SO2氣體和Cl2同時作用于濕潤的紅色布條,漂白效果將更好 | |
| B. | SO2氣體和Cl2 漂白原理相同 | |
| C. | SO2氣體和Cl2均是有毒氣體 | |
| D. | SO2只有氧化性沒有還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
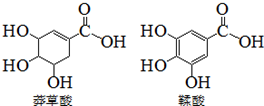 莽草酸是一種合成藥物達菲的原料,鞣酸存在于蘋果、生石榴等植物中.下列關于這兩種有機化合物的說法正確的是( )
莽草酸是一種合成藥物達菲的原料,鞣酸存在于蘋果、生石榴等植物中.下列關于這兩種有機化合物的說法正確的是( )| A. | 兩種酸遇三氯化鐵溶液都顯色 | |
| B. | 鞣酸分子比莽草酸分子多兩個雙鍵 | |
| C. | 等物質的量的兩種酸與NaOH反應,消耗NaOH的量相同 | |
| D. | 兩種酸都能與溴水反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
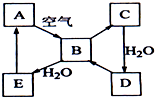 如圖表示淡黃色固態單質A及其化合物之間的轉化關系(某些產物和反應條件已略去).化合物B在常溫常壓下為氣體,B和C的相對分子質量之比為4:5,化合物D是重要的工業原料.
如圖表示淡黃色固態單質A及其化合物之間的轉化關系(某些產物和反應條件已略去).化合物B在常溫常壓下為氣體,B和C的相對分子質量之比為4:5,化合物D是重要的工業原料.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 油脂是產生能量最高的營養物質 | |
| B. | 苯能發生氧化反應 | |
| C. | 纖維素可在人體內最終水解成葡萄糖 | |
| D. | 谷氨酸分子中含有2種官能團 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯水和二氧化硫使品紅溶液褪色 | |
| B. | 稀硝酸和三氯化鐵溶液使KI-淀粉試紙變藍 | |
| C. | 亞硫酸鈉和水玻璃長期暴露在空氣中變質 | |
| D. | 濃鹽酸和濃硫酸長期暴露在空氣中濃度變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬在空氣中加熱均可生成多種氧化物 | |
| B. | 堿金屬與水反應,均浮在水面上. | |
| C. | 鹵素各單質都能和水劇烈反應. | |
| D. | 鹵素單質越活潑,其熔沸點就越低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3N4是分子晶體 | |
| B. | C3N4晶體中微粒通過離子鍵結合 | |
| C. | C3N4晶體具有導電性和延展性 | |
| D. | C3N4晶體是以C、N原子為基本微粒,共價鍵為作用力的空間網狀結構 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com