
A.10∶7∶11 B.11∶11∶8? C.10∶11∶8 D.10∶12∶9?
 孟建平小學滾動測試系列答案
孟建平小學滾動測試系列答案科目:高中化學 來源: 題型:
| 酸或堿 | 電離平衡常數(Ka或Kb) |
| CH3COOH | 1.8×10-3 |
| HNO3 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化學 來源:浙江省杭州高級中學2012屆高三第三次月考化學試題 題型:022
運用化學反應原理研究氮、氧等單質及其化合物的反應有重要意義.
(1)合成氨反應N2(g)+3H2(g)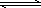 2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,則平衡________移動(填“向左”“向右”或“不”);使用催化劑,上述反應的ΔH________(填“增大”“減小”或“不改變”).
2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,則平衡________移動(填“向左”“向右”或“不”);使用催化劑,上述反應的ΔH________(填“增大”“減小”或“不改變”).
(2)一氧化碳在高溫下與水蒸氣反應的方程式為:CO+H2O=CO2+H2.已知部分物質燃燒的熱化學方程式如下:
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 kJ·mol-
2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
又知1 mol H2O(g)轉變為1 mol H2O(l)時放出44.0 kJ熱量.寫出CO和水蒸氣在高溫催化劑下反應的熱化學方程式________.
(3)在25℃下,向濃度均為0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化學式),生成該沉淀的離子方程式為________.已知25℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
(4)有人設想尋求合適的催化劑和電極材料,以N2、H2為電極反應物,以HCl-NH4Cl為電解質溶液制造新型燃燒電池,放電過程中,溶液中銨根離子濃度逐漸增大.請寫出該電池的正極反應式________.
(5)某溫度(t℃)時,測得0.01 mol·L-1的NaOH溶液的pH=11.在此溫度下,將pH=1的H2SO4溶液VaL與pH=11的NaOH溶液VbL混合,若所得混合液為中性,則Va∶Vb=________.
(6)在25℃下,將a mol·L-1的氨水與0.01 mol·L-1的鹽酸等體積混合,反應平衡時溶液中c(NH4+)=c(Cl-).則溶液顯________性(填“酸”“堿”或“中”);
(7)NH4Cl是一種重要的化肥.
①用0.1 mol·L-1的鹽酸滴定0.1 mol·L-1的氨水,滴定過程中不可能出現的結果是:
a.c(NH![]() )=c(Cl-),c(OH-)=c(H+)
)=c(Cl-),c(OH-)=c(H+)
b.c(NH![]() )>c(Cl-),c(OH-)<c(H+)
)>c(Cl-),c(OH-)<c(H+)
c.c(NH![]() )>c(Cl-),c(OH-)>c(H+)
)>c(Cl-),c(OH-)>c(H+)
d.c(NH![]() )<c(Cl-),c(OH-)>c(H+)
)<c(Cl-),c(OH-)>c(H+)
②NH4Cl溶液中存在:NH4++H2O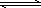 NH3·H2O+H+,則該反應常溫下的平衡常數K=________(已知:常溫下,NH3·H2O的電離平衡常數Kb=1.7×10-5 mol·L-1)
NH3·H2O+H+,則該反應常溫下的平衡常數K=________(已知:常溫下,NH3·H2O的電離平衡常數Kb=1.7×10-5 mol·L-1)
查看答案和解析>>
科目:高中化學 來源:2012-2013學年湖北荊門高二上學期期末教學質量檢測化學試卷(帶解析) 題型:填空題
(1)已知某溶液中只存在OH-、H+、NH4+、Cl-四種離子,某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
①若溶液中只溶解了一種溶質,該溶質的名稱是 ,上述離子濃度大小順序關系中正確的是(選填序號) 。
②若上述關系中C是正確的,則溶液中溶質的化學式是 。
③若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)與c(Cl-)的關系c(NH4+) c(Cl-)。
(2)在25℃條件下將pH=11的氨水稀釋100倍后溶液的pH為(填序號) 。
A.9 B.9~11之間 C.11~13之間 D.13
(3)25℃時,向0.1mol/L的氨水中加入少量氯化銨固體,當固體溶解后,測得溶液pH減小,主要原因是(填序號) 。
A.氨水與氯化銨發生化學反應;
B.氯化銨溶液水解顯酸性,增加了c(H+);
C.氯化銨溶液水解顯堿性,降低了c(H+);
D. 氯化銨溶于水,電離出大量銨根離子,抑制了氨水的電離,使c(OH-)減小;
查看答案和解析>>
科目:高中化學 來源:2014屆湖北荊門高二上學期期末教學質量檢測化學試卷(解析版) 題型:填空題
(1)已知某溶液中只存在OH-、H+、NH4+、Cl-四種離子,某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
①若溶液中只溶解了一種溶質,該溶質的名稱是 ,上述離子濃度大小順序關系中正確的是(選填序號) 。
②若上述關系中C是正確的,則溶液中溶質的化學式是 。
③若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)與c(Cl-)的關系c(NH4+) c(Cl-)。
(2)在25℃條件下將pH=11的氨水稀釋100倍后溶液的pH為(填序號) 。
A.9 B.9~11之間 C.11~13之間 D.13
(3)25℃時,向0.1mol/L的氨水中加入少量氯化銨固體,當固體溶解后,測得溶液pH減小,主要原因是(填序號) 。
A.氨水與氯化銨發生化學反應;
B.氯化銨溶液水解顯酸性,增加了c(H+);
C.氯化銨溶液水解顯堿性,降低了c(H+);
D. 氯化銨溶于水,電離出大量銨根離子,抑制了氨水的電離,使c(OH-)減小;
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)已知某溶液中只存在OH-、H+、NH4+、Cl-四種離子,某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
①若溶液中只溶解了一種溶質,該溶質的名稱是 ,上述離子濃度大小順序關系中正確的是(選填序號) 。
②若上述關系中C是正確的,則溶液中溶質的化學式是 。
③若該溶液中由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)與c(Cl-)的關系c(NH4+) c(Cl-)。
(2)在25℃條件下將pH=11的氨水稀釋100倍后溶液的pH為(填序號) 。
A.9 B.9~11之間 C.11~13之間 D.13
(3)25℃時,向0.1mol/L的氨水中加入少量氯化銨固體,當固體溶解后,測得溶液pH減小,主要原因是(填序號) 。
A.氨水與氯化銨發生化學反應;
B.氯化銨溶液水解顯酸性,增加了c(H+);
C.氯化銨溶液水解顯堿性,降低了c(H+);
D. 氯化銨溶于水,電離出大量銨根離子,抑制了氨水的電離,使c(OH-)減小;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com